
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
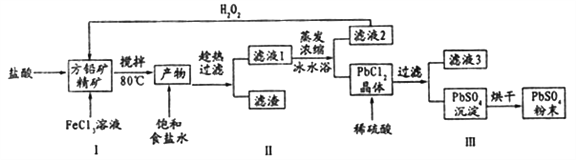
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
【答案】 PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓ 冰水浴可以使吸热反戍PbCl2(s)十2Cl-(aq)![]() PbCl4-(aq)逆向移动。PbCl4-不断转化为PbCl2晶体而析出 FeCl3和盐酸 PbCl2(s)+SO42-(aq)
PbCl4-(aq)逆向移动。PbCl4-不断转化为PbCl2晶体而析出 FeCl3和盐酸 PbCl2(s)+SO42-(aq) ![]() PbSO4(s) +2Cl-(aq) B 正极 Ca+2Cl--2e-=CaCl2 20.7
PbSO4(s) +2Cl-(aq) B 正极 Ca+2Cl--2e-=CaCl2 20.7
【解析】(1)本题考查氧化还原反应方程式的书写,淡黄色的沉淀是S,方铅矿中加入盐酸和FeCl3,FeCl3具有强氧化性,把-2价S氧化成S,且PbCl2属于难溶物,因此离子反应方程式为:PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓;(2)考查勒夏特列原理,产物中加入NaCl,发生PbCl2+2Cl-![]() PbCl42-,此反应是吸热反应,采用冰水浴,促使平衡向正反应方向进行,生成PbCl2;(3)考查对流程的分析,滤液2中加入H2O2,H2O2把Fe2+氧化成Fe3+,FeCl3可以循环使用,PbCl2中加入稀硫酸,发生PCl2+H2SO4=PbSO4+2HCl,盐酸可以循环使用;(4)考查沉淀的转化,PbCl2和PbSO4都难溶于水,且PbSO4比PbCl2更难溶,离子反应方程式为PbCl2(s)+SO42-(aq)
PbCl42-,此反应是吸热反应,采用冰水浴,促使平衡向正反应方向进行,生成PbCl2;(3)考查对流程的分析,滤液2中加入H2O2,H2O2把Fe2+氧化成Fe3+,FeCl3可以循环使用,PbCl2中加入稀硫酸,发生PCl2+H2SO4=PbSO4+2HCl,盐酸可以循环使用;(4)考查沉淀的转化,PbCl2和PbSO4都难溶于水,且PbSO4比PbCl2更难溶,离子反应方程式为PbCl2(s)+SO42-(aq) ![]() PbSO4(s) +2Cl-(aq);(5)根据反应方程式,Pb以Pb2+形式参与反应,pH过小,平衡向逆反应方向进行,pH过大,以Pb(OH)2全部沉淀,因此pH控制在6~7之间,故选项B正确;(6)考查电极反应式的书写和原电池的工作原理,①根据原电池的工作原理,阳离子向正极移动,即Li+向正极移动;②负极是失去电子,化合价升高的反应,Ca在负极上反应,电极反应式为Ca+2Cl--2e-=CaCl2;③PbSO4失去2mol电子转变成Pb,因此转移0.2mol电子生成Pb的质量为207×2/0.2g=20.7g。
PbSO4(s) +2Cl-(aq);(5)根据反应方程式,Pb以Pb2+形式参与反应,pH过小,平衡向逆反应方向进行,pH过大,以Pb(OH)2全部沉淀,因此pH控制在6~7之间,故选项B正确;(6)考查电极反应式的书写和原电池的工作原理,①根据原电池的工作原理,阳离子向正极移动,即Li+向正极移动;②负极是失去电子,化合价升高的反应,Ca在负极上反应,电极反应式为Ca+2Cl--2e-=CaCl2;③PbSO4失去2mol电子转变成Pb,因此转移0.2mol电子生成Pb的质量为207×2/0.2g=20.7g。


科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是
A. 吸带过滤嘴的香烟,对人体无害
B. 保护环境就是保护人类自己
C. 纯天然物质配成的饮料,不含任何化学物质
D. 水可以变为油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成是目前普遍使用的人工固氮方法。
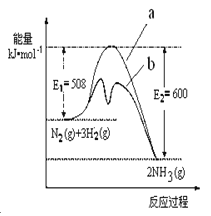
(1) 根据图提供的信息,写出该反应的热化学方程 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1) 物质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3,pH由小到大的排列顺序是___________ (用字母表示)
(2) 常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______ (填序号)
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH—) D.c(OH-)/c(H+)
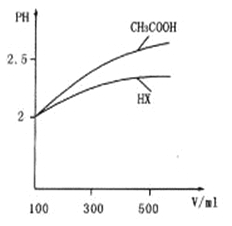
(3) 体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_______ (填“>”、“<”或“=”)CH3COOH的电离平衡常数。
(4) 25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中:
① c(CH3COO—)—c(Na+)=_______ mol·L—1(填精确值)
② c(CH3COO-)/c(CH3COOH)=_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中不正确的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)

选项 | 预测物质的化学式 | 预测所需指示剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]
甲苯在医药、农药,特别是香料合成中应用广泛,可合成以下物质:
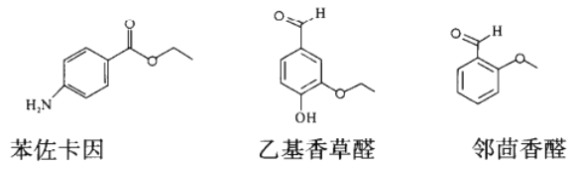
(1)苯佐卡因中含有的碱性官能团为____________(填名称)。
(2)乙基香草醛和邻茴香醛具有相同的亲水基团,该基团可用________(填物理方法)检测。
(3)写出符合下列条件的乙基香草醛的同分异构体的结构简式______(任写两种)。
a.苯环上连接两个互为对位的基团 b.有一个-CH3
c.与FeCl3溶液发生显色反应 d.能发生水解反应
(4)已知:
有机物M为含有两个互为邻位基团的芳香族化合物,且与本佐卡因互为同分异构,其合成路线如下:
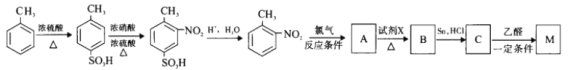
①生成A的“反应条件”为________;
②以上合成路线涉及的7个反应中,属于取代反应的有_________个;
③M的结构简式为___________;
④A→B反应的化学方程式为____________。
(5)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选),设计制备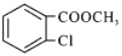 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com