
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。

根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为____________________
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写2种)。
【答案】(1)4s24p1(2)d 0 (3)N2CN-、NO+、C
(4)CH4、CH3OH (5)正四面体 CO2、NCl3、CCl4、CO
【解析】试题分析:(1)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2;
(4)在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化;
(5)根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+(7+1-4×2)=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2CCl4。


科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M 样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL 和V2 mL(已折算到标准状况下)。

(1)实验1 装置中小试管的作用是_______________。
(2)对于实验2,平视读数前应依次进行的两种操作是:
①______________;②________________________。
(3)实验1 进行实验前,B 瓶中水没有装满,使测得气体体积_____ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2 中导管a,使测得气体体积_____________。
(4)该实验需要0.50 mol·L-1 的NaOH 溶液470 mL,请回答下列问题
①配制时应称量______g NaOH,配制过程所需仪器____________ (填仪器名称)。
②配制NaOH 溶液时,NaOH 固体中含有Na2O 杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ =1.84g/cm3)配制的,若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
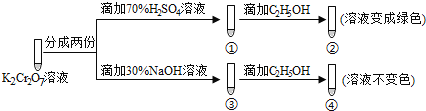
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,则该元素位于周期( )
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣA族 D. 第3周期ⅣB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
![]()
1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
A.中心原子的价层电子对数目相等 |
B.都是极性分子 |
C.中心原子的孤对电子数目相等 |
D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修2:化学与技术]
直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可参与下图所示的几个工厂利用废气,废渣(液)联合生产化肥硫酸铵的工艺。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有____________。(填写字母编号)
A.温室效应 B.酸雨 C.粉尘污染 D.水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为_________。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为:________。
(3)工艺操作①、②分别为___________、___________。
(4)工业合成氨的原料氢气来源是水和碳氢化合物,请写出以天然气为原料制取氢气的化学方程式:_____________。
(5)写出生成“产品”的离子方程式:_______。
(6)副产品的化学式为______________。该联合生产工艺中可以循环使用的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= 。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是 、 。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计如图实验装置(夹持装置略去)制备氯气并探究氯气的相关性质。D装置为分液漏斗形状,低进高出。
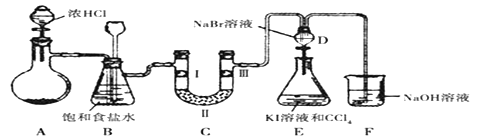
(1)若A装置中固体药品为MnO2,写出其离子反应方程式_________;若A装置中固体药品为KC1O3,则反应中每生成1 mol Cl2时转移电子数目为_______________。
(2)装置B的作用是______和________,若C处发生了堵塞,则B中的现象__________。
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________和__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com