
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是 ( )
A.水、双氧水、水玻璃都是纯净物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中足球烯C60最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是

A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
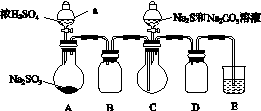
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1 )大于反应Ⅱ的速率(v2 ),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________________________。
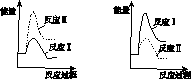
A B
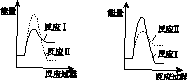
C D
(5)图(a)为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图(b)画出反应体系中c(SO2)随时间t变化的总趋势图。
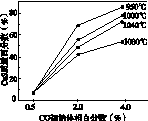
(a) (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有K+、NH4+、Ba2+、SO42一、I一、 CO32一。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )
A.K+ B.SO42一 C.Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是( )
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol
B.等物质的量的CH4在反应①、②中转移电子数相同
C.若用标准状况下4.48L CH4把NO2还原为N2(生成的水为气态),放出热量173.4kJ
D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl-的物质的量浓度最大的是( )
A.300 mL 3.5 mol/L KCl溶液 B.1 000 mL 2.5 mol/L NaCl溶液
C.250 mL 1 mol/L AlCl3溶液 D.200 mL 2 mol/L MgCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com