
A.等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图像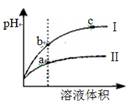 |
| B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)<c(NH4HCO3) |
| D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+) |
| C.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-) |
| D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、SiO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、S2-、OH-、SO42- |
| D.Na+、CO32-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、Fe2+、Cr2O72—、SO42— |
| B.Ca2+、H+、SO42—、HCO3— |
| C.Na+、Cu2+、Cl-、S2- |
| D.Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4,振荡,静置 | CCl4层呈橙红色 |
| ③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Na+、OH—、MnO4- | B.Ba2+、Cu2+、NO3—、SO42— |
| C.Mg2+、Na+、OH—、SO42— | D.Cl—、Ba2+、NO3—、OH— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气:K+、Ba2+、SiO32-、NO3- |
| B.二氧化硫:Na+、NH4+、SO32-、C1- |
| C.氨气:K+、Na+、AlO2-、CO32- |
| D.甲醛:Ca2+、Mg2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题: Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com