
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是氧化性气体 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | 向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中 | 产生白色浑浊 | 酸性:醋酸>碳酸>苯酚 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A.AB.BC.CD.D
【答案】D
【解析】
A. 该气体可能是氨气,也可能是氧化性气体,若是氨气,反应产生BaSO3白色沉淀;若是氧化性气体,反应产生的是BaSO4白色沉淀,A错误;
B. CO2与溶液中的水反应产生H2CO3是弱酸,不能溶解反应产生的两性物质Al(OH)3,所以产生沉淀但不能溶解,B错误;
C. 冰醋酸具有挥发性,苯酚钠溶液中产生的白色沉淀可能是醋酸与苯酚钠反应产生,也可能是CO2气体反应产生,不能比较碳酸与苯酚的酸性强弱,C错误;
D. 向盛有KI3溶液的试管中加入淀粉溶液溶液变为蓝色,证明溶液中含有I2;加入AgNO3溶液后产生黄色沉淀,证明溶液中含有I-,因此可证明在溶液中存在平衡:I3-![]() I2+I-,D正确;
I2+I-,D正确;
答案选D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中将CO2与含少量CO的H2混合生成甲醇,反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图表示按![]() 分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
分别为①1:4和②1:6两种投料比时,CO2的平衡经随温度变化的曲线。
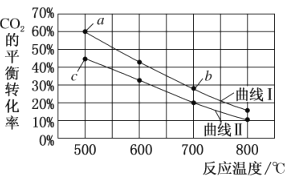
设①②两种投料比时CO2投料的物质的量浓度相等。下列有关说法正确的是
A.按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线l
B.图中a点对应的H2的转化率为30%
C.图中b点对应的平衡常数K的值大于c点
D.![]() 的数值,a点比c点小
的数值,a点比c点小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe![]() ”的实验中检测到
”的实验中检测到![]() 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的![]() 硝酸银溶液(
硝酸银溶液(![]() )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有![]() 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有![]() ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
I | 3 | 产生大量白色沉淀;溶液呈红色 |
II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对![]() 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生![]()
假设b:空气中存在![]() 发生反应
发生反应![]() 产生
产生![]()
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d
下述实验可证实假设a、b,c不是产生Fe3+的主要原因,并可证实假设d成立。
①实验:向硝酸酸化的__________溶液( ![]() )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7)。
(1)用离子方程式表示该溶液中存在的三个平衡体系___、___、__。
(2)溶液中各离子的物质的量浓度由大到小顺序为___。
(3)溶液中粒子中浓度为0.1mol/L的是___,浓度为0.05mol/L的是__。
(4)物质的量之和为0.lmol的两种粒子是___与___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥、破碎的目的是_______。
(2)操作I需要的玻璃仪器主要有:烧杯、漏斗、______,操作Ⅱ的名称是_____。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)某学生对青蒿素的性质进行探究:将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_____(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】星型聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。

已知:SPLA的结构简式为: ,其中R为
,其中R为 。
。
(1)淀粉是___糖(填“单”或“多”);A的名称是___。
(2)生成D的化学反应类型属于___反应;D结构中有3个相同的基团,且1 mol D能与2 mol Ag(NH3)2OH溶液反应,则D的结构简式是___;D→E反应的化学方程式为___。
(3)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2悬浊液反应,且1mol G与足量Na反应生成1 mol H2,则G的结构简式为___。
(4)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com