
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
| 7.2g |
| 160g/mol |
| 3.8g |
| 18g/mol |
| 0.21 |
| 0.045 |


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:阅读理解
 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
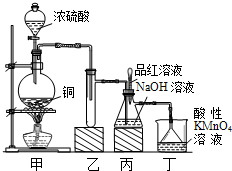 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | / |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 |
若品红褪色(或有气泡),则 |
| 步骤3: |
若 则 否则 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
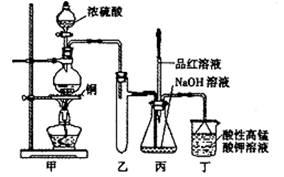
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com