
【题目】化合物K是有机光电材料中间体。由芳香族化合物A制备K的合成路线如下:
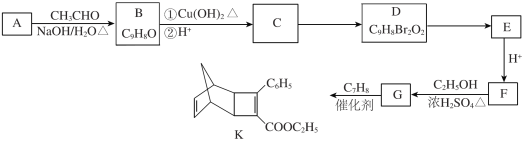
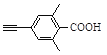
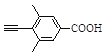
已知:![]()
![]()
回答下列问题:
(1)A的结构简式是________。
(2)C中官能团是________。
(3)D→E的反应类型是________。
(4)由F生成G的化学方程式是________。
(5)C7H8的结构简式是________。
(6)芳香族化合物X是G的同分异构体,该分子中除苯环外,不含其他环状结构,其苯环上只有1种化学环境的氢。X能与饱和碳酸氢钠溶液反应放出CO2,写出符合上述要求的X的结构简式:________。
(7)以环戊烷和烃Q为原料经四步反应制备化合物![]() ,写出有关物质的结构简式(其他无机试剂任选)。
,写出有关物质的结构简式(其他无机试剂任选)。![]() Q:____;中间产物1:________;中间产物2:____;中间产物3:________。
Q:____;中间产物1:________;中间产物2:____;中间产物3:________。
【答案】![]() 碳碳双键 羧基 消去反应
碳碳双键 羧基 消去反应 ![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O ![]()
 CH3—C≡C—CH3
CH3—C≡C—CH3 ![]()
![]()
![]()
【解析】
由第一个信息可知A应含有醛基,且含有7个C原子,应为![]() ,则B为
,则B为![]() ,则C为
,则C为![]() ,D为
,D为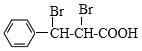 ,E为
,E为![]() ,F为
,F为![]() ,F与乙醇发生酯化反应生成G为
,F与乙醇发生酯化反应生成G为![]() ,对比G、K的结构简式并结合第二个信息,可知C7H8的结构简式为
,对比G、K的结构简式并结合第二个信息,可知C7H8的结构简式为![]() ;
;
(7)环戊烷与氯气在光照条件下生成![]() ,
,![]() 发生消去反应得到环戊烯。环戊烯与2-丁炔发生加成反应生成
发生消去反应得到环戊烯。环戊烯与2-丁炔发生加成反应生成![]() ,然后与溴发生加成反应生成
,然后与溴发生加成反应生成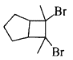 。
。
根据上述分析可知:A为![]() ,B为
,B为![]() ,
,![]() ,D为
,D为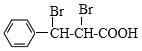 ,E为
,E为![]() ,F为
,F为![]() ,G为
,G为![]() ,对比G、K的结构简式并结合题中给出的第二个信息,可知C7H8的结构简式为
,对比G、K的结构简式并结合题中给出的第二个信息,可知C7H8的结构简式为![]() 。
。
(1)A的结构简式是![]() 。
。
(2)C结构简式是![]() 其中含有的官能团是碳碳双键和羧基。
其中含有的官能团是碳碳双键和羧基。
(3)D→E的反应类型为消去反应。
(4) F为![]() ,F与乙醇在浓硫酸存在的条件下加热,发生消去反应形成G
,F与乙醇在浓硫酸存在的条件下加热,发生消去反应形成G![]() 和水,所以由F生成G的化学方程式是
和水,所以由F生成G的化学方程式是![]() +C2H5OH
+C2H5OH![]()
![]() +H2O。
+H2O。
(5)C7H8的结构简式是![]() 。
。
(6)芳香族化合物X是G的同分异构体,该分子中除苯环外,不含其他环状结构,其苯环上只有1种化学环境的氢。X能与饱和碳酸氢钠溶液反应放出CO2,说明分子中含有羧基-COOH,则符合上述要求的X的结构简式: 、
、 。
。
(7)环戊烷与氯气在光照条件下生成,![]() ,
,![]() 与NaOH的乙醇溶液共热,发生消去反应得到环戊烯、NaCl、H2O。环戊烯与2-丁炔发生加成反应生成
与NaOH的乙醇溶液共热,发生消去反应得到环戊烯、NaCl、H2O。环戊烯与2-丁炔发生加成反应生成![]() ,然后与溴发生加成反应生成
,然后与溴发生加成反应生成 。其合成路线为
。其合成路线为![]()
![]()
![]()
![]()
![]()
![]()
![]()
 。所以Q:CH3—C≡C—CH3;中间产物1:
。所以Q:CH3—C≡C—CH3;中间产物1:![]() ;中间产物2:
;中间产物2:![]() ;中间产物3:
;中间产物3:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物 ![]() 和
和 ![]() 的说法正确的是( )
的说法正确的是( )
A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D. ![]() 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. NaCl的摩尔质量是58.5gB. 64g氧气中含有2mol氧
C. 4g氦气中含有2mol氦原子D. 0.1molCO2中含有6.02×1022个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2 和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得 CO2 和 CH3OH(g)的浓度随时间变化如图:
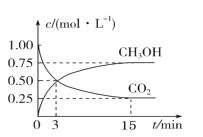
(1)从 3 min 到 15min,υ(H2)=____molL-1min-1;
(2)能说明上述反应达到平衡状态的是_____填编号)。
A. 反应中 CO2 与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2 的转化率为 _____。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是 ______。
(5)第 3 分钟时υ正(CH3OH)______第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明C2H5X(X=Cl、Br或 I)中存在溴原子,某同学设计如下实验:
Ⅰ.向C2H5X中加入硝酸银溶液,充分振荡后静置,液体分为两层,均为无色溶液;
Ⅱ.向C2H5X中加入氢氧化钠溶液,充分振荡后静置,液体分为两层,均为无色溶液;
Ⅲ.取Ⅱ中……。
(1)Ⅰ为对照实验,目的是_______。
(2)写出Ⅱ中的化学方程式:_______。
(3)补全Ⅲ中的实验操作及现象:_______,说明C2H5X中含溴原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3-
B.硅酸钠溶液与醋酸溶液混合: SiO32-+ 2H+ = H2SiO3↓
C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有19.2克铜与400毫升稀硝酸发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥表示出电子转移的方向和数目_____________
(2)计算稀硝酸的物质的量浓度_____________
(3)计算产生的气体在标况下的体积_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为________,其中M原子的配位数为________。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是________(写元素符号)。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为__________g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com