
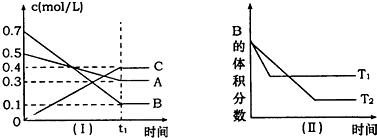
| A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | B、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | C、T℃时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L | D、(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动 |
| (0.4)2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |
| (0.4)2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示. C
C C
C查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
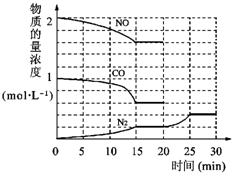 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某温度下,密闭容器中,发生如下可逆反应:2E(g)![]() F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
①若X=1,容器体积保持不变,新平衡下E的体积分数为________.
②若X=2,容器体积保持不变,新平衡下F的平衡浓度____0.5a mol/L。
(2)t℃将3mol A气体和1mol B气体通入2L固定体积的密闭容器中,发生如下反应:3A(g) + B(g)![]() xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
①从开始反应至达到平衡状态,生成C的平均反应速率为_________,X=_____.
②若继续向原平衡混合物中通入少量氦气(不参与反应)后,化学平衡将____移动。
③若向原平衡混合物的容器中再充入a molC,在t℃达到新的平衡,此时B的物质的量为n(B)=_____________mol。
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)n(B) n(C)之间应该满足的关系为_____________________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
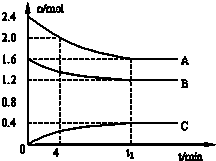
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省温州市十校高二(下)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com