
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)= mol/(L·min).
②在2min~4min间,v(Cl2)正 v(Cl2)逆 (填“>”、“=”或“<”),该温度下K= .
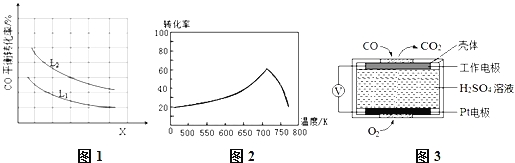
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是 ;a 0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 .
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为 ;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式 .
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
【答案】
(1)①0.1;②=;5;③温度;<;
(2)①温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;②CO-2e-+H2O═CO2+2H+;2NO+3H2O2═2NO3-+2H2O+2H+;
(3)c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)。
【解析】
试题分析:(1)①由表中数据,可知0~2min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)=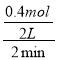 =0.1mol/(L.min),故答案为:0.1;
=0.1mol/(L.min),故答案为:0.1;
②4min内,反应的氯气为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆,由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K=![]() =
=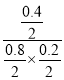 =5,故答案为:=;5;
=5,故答案为:=;5;
③正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,故答案为:温度;<;
(2)①当温度升高到710K时,单位时间内反应达平衡,由于该反应是放热反应,再升高温度,平衡向左移动,转化率降低,故答案为:温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;
②该装置是原电池,通入一氧化碳的电极是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+H2O═CO2+2H+,NO被H2O2溶液氧化成强酸硝酸,双氧水被还原成水,则反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+,故答案为:CO-2e-+H2O═CO2+2H+;2NO+3H2O2═2NO3-+2H2O+2H+;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故答案为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g) ![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25[o] | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示, 该气体所含原子总数为________个,该气体在标准状况下的体积为________L。
(2) 在标准状况下,由CO和CO2组成的混合气体为67.2 L,质量为120 g,此混合物中CO和CO2物质的量之比是________, CO的质量是________,混合气体的平均摩尔质量是 。
(3)若40 g密度为ρ g·cm-3的硝酸钙溶液里含2 g Ca2+,则NO![]() 的物质的量浓度是____________。
的物质的量浓度是____________。
(4)将标准状况下的VL氨气溶于100g水中,得到的氨水密度为ag/cm3,则该溶液的物质的量浓度为 。
(5)标准状况下,现有①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3,对这四种气体的关系有以下四种表述:其中正确的是____________
a.体积:②>③>①>④ b.物质的量:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
(6)按体积比为1:2:3所组成的N2、O2、CO2,混合气体20g在标准状况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.甲烷与氯气的混合气体在光照条件下反应
B.丙烯和氯气在一定条件下反应生成ClCH2CH===CH2的反应
C.乙烯使酸性高锰酸钾溶液褪色
D.乙烯与HCl气体反应生成一氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.共价化合物中不可能含有离子键
B.H2O比H2S稳定,H—S键比H—O键更难断裂
C.最外层只有一个电子的原子与卤素原子形成的化学键可能是离子键,也可能是共价键
D.离子键和共价键的实质都是电性的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C.NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D.向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I- = 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种无机物①SO2、②SiO2·nH2O、③Al(OH)3中,可用作胃酸中和剂的是_____(填序号,下同),可用作漂白纸浆的是______,可用作食品干燥剂的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com