
【题目】下列物质不能与氢氧化钠溶液反应的是
A. Al B. Fe2O3 C. Al(OH)3 D. NaHCO3
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们质量总和不到体重的千分之一,但是对人的健康却起着重要作用,下列各组元素全部是微量元素的是
A. Na、K、Cl、S、O
B. I、Fe、Zn、Cu
C. N、H、O、P、C
D. Ge、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
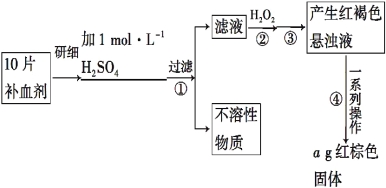
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为______________________。
(2)步骤②加入过量H2O2的目的是 _______________________。
(3)步骤④中反应的化学方程式是 _______________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、 、称量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一个选项中所列的物质均属于动物或植物常利用的能源物质
A. 淀粉糖原纤维素脂肪 B. 淀粉糖原磷脂脂肪
C. 淀粉糖原葡萄糖脂肪 D. 淀粉糖原核糖脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.活化分子之间的碰撞即为有效碰撞
B.使用催化剂能降低活化能,增加活化分子百分数
C.增大压强不能降低活化能,但能增加活化分子百分数
D.活化能的大小决定了反应能否自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:
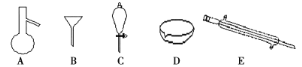
(1)写出上述仪器的名称:A___________,C________________,E________。
(2)分离以下混合物应该主要选用上述什么仪器(填字母)
①粗盐和泥沙:___________;②花生油和水:____________。
(3)关于仪器的使用,下列说法不正确的是________。
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?______________。
(5)下列是进行该操作的步骤,正确的顺序是___________。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接收溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品.
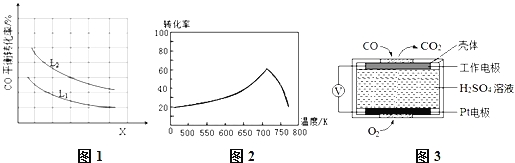
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)= mol/(L·min).
②在2min~4min间,v(Cl2)正 v(Cl2)逆 (填“>”、“=”或“<”),该温度下K= .
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是 ;a 0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 .
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为 ;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式 .
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com