
【题目】下列说法不正确的是 ( )
A.工业制取硫酸过程中生成的SO2可循环利用
B.钢铁因含杂质而容易生锈,所以合金一定不耐腐蚀
C.沙子、石英、水晶、硅藻土都是天然存在的二氧化硅
D.在医疗上硫酸亚铁可用作生产防治缺铁性贫血的药剂
科目:高中化学 来源: 题型:
【题目】已知HF 酸性强于CH3COOH,常温下有下列三种溶液.有关叙述不正确的是( )
编号 | ① | ② | ③ |
PH | 11 | 3 | 3 |
溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
A.CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO﹣)/c(Na+)增大
B.①、②等体积很合后:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.向②加入NaF固体,CH3COOH电离平衡正向移动
D.中和相同体积的②、③,需消耗①的体积②<③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣3 mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1: 己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用:催化剂和;反应中加入过量的乙醇,目的是 .
(2)仪器C的名称是 , 其作用有冷凝乙酸乙酯和 , 若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为 .
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: .
(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图: 
则试剂a是: , 试剂b是: . 分离方法I是 , 分离方法II是
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功. 试解答下列问题:
①甲实验失败的原因是: .
②乙实验失败的原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加少量稀硫酸将溶液酸化,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。写出该过程的所有离子反应方程式:___________________________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
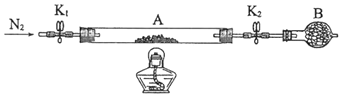
①仪器B的名称是______________。
②将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
A.点燃酒精灯,加热
B.熄灭酒精灯
C.关闭K1和K2
D.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______________。(列式表示).若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)测定硫酸亚铁的分解产物发现:一种产物为红棕色固体,另外两种产物为气体,反应产物中氧化产物与还原产物的物质的量相等,写出该过程的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出FeCl3的电离方程式:_____________________,
(2)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:____________,
(3)胶体是一种常见的分散系,回答下列问题.
①向煮沸的蒸馏水中逐滴加入_______溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________.
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做______.
③区分胶体和溶液常用的方法叫做________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mloI·L-1H2SO4溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、HCO3-
C.0.l mol·L-lNaClO溶液:Fe2+、K+、I一、Cl-
D.c(OH-)/c(H+)=lxl014的溶液:Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com