
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�����ϡ���Ὣ��Һ�ữ���μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣д���ù��̵��������ӷ�Ӧ����ʽ��___________________________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ������˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣
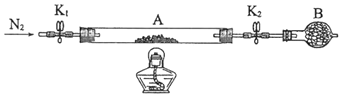
������B��������______________��
�ڽ�����ʵ�����������ȷ����_______�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
A����ȼ�ƾ��ƣ�����
B��Ϩ��ƾ���
C���ر�K1��K2
D����K1��K2������ͨ��N2
e.����A
f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=_______________������ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3���ⶨ���������ķֽ����֣�һ�ֲ���Ϊ����ɫ���壬�������ֲ���Ϊ���壬��Ӧ���������������뻹ԭ��������ʵ�����ȣ�д���ù��̵Ļ�ѧ����ʽ��________________________��
���𰸡� 4Fe2++O2+4H+=4Fe3++2H2O ��Fe3++3SCN��= Fe(SCN)3 ����� dabfce ![]() ƫС 2FeSO4
ƫС 2FeSO4![]() Fe2O3+SO2��+SO3��
Fe2O3+SO2��+SO3��
����������1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�����ϡ���Ὣ��Һ�ữ���μ�KSCN��Һ����Һ��ɫ�����Ա仯��˵����Һ��û��Fe3+�������Թ���ͨ���������Һ�����˵��������������Fe2+��O2����ΪFe3+���ù����Ⱥ����������ӷ�Ӧ�����ӷ���ʽ�ֱ�Ϊ4Fe2++O2+4H+=4Fe3++2H2O��Fe3++3SCN��= Fe(SCN)3.
��2��������B�������Ǹ���ܡ�
��ʵ�������������Ϊ����K1��K2������ͨ��N2 ���ų�ϵͳ�ڵ���������ֹ��������ʵ�飩����ȼ�ƾ��ƣ����ȣ����̷����ʧȥ�ᾧˮ����Ϩ��ƾ�������ȴ������(���ڼ����ͨ�뵪����ˮ��������ų�������֤����ʱ��������¶ȡ���ѹ��ͬ)���ر�K1��K2 ������A ������ʵ�����������ȷ����Ϊdabfce���ظ������������裬ֱ��A���أ���Ϊm3 g��
�۸���ʵ���¼��֪���̷�������Ϊ(m2-m1)g����������������Ϊ(m3-m1)g�����̷��Ļ�ѧʽΪFeSO4xH2O����![]() ����֮���̷���ѧʽ�нᾧˮ��Ŀx=
����֮���̷���ѧʽ�нᾧˮ��Ŀx=![]() ����ʵ��ʱ��a��d��������������������ᱻ�������������õ�����m3ƫ��ʹxƫС��
����ʵ��ʱ��a��d��������������������ᱻ�������������õ�����m3ƫ��ʹxƫС��
��3�������������ķֽ�����֪������ɫ����Ϊ�������������������ֱ�Ϊ�����������������Ӧ���������������뻹ԭ��������ʵ�����ȣ����Ըù��̵Ļ�ѧ����ʽΪ2FeSO4![]() Fe2O3+SO2��+SO3����
Fe2O3+SO2��+SO3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��������ȡ��ȩ��CH3OH��g��HCHO��g��+H2��g�����״���ƽ��ת�������¶ȱ仯������ͼ��ʾ����֪��Ӧ��1L���ܱ������н��С��״������ʵ���Ϊ1mol���������й�˵������ȷ���ǣ� �� 
A.���ⷴӦ�ġ�H��0
B.600 Kʱ��Y��״���v���棩��v������
C.��Y�㵽Z���ͨ������ѹǿ
D.��t1Kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ8.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƽ��ȡ 10.1g NaOH ����,���в����У���ȷ����
A. �� NaOH ������ƽ��������е�ֽƬ��
B. �� NaOH �����ձ��У��ձ������ѳ��أ�����������ƽ�ұ�������
C. ������ȡ���궨Ϊ 10.1g �����������ƽ�ұߵ�������
D. ������ȡ���궨Ϊ10g�����������ƽ�ұߵ������ϣ��������������Ƶ� 0.1gλ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����Ϊ��ȡCu2O�����ַ�����
������ | ��̿���ڸ��������»�ԭCuO |
������ | ��ⷨ��2Cu+H2O |
������ | ���£�N2H4����ԭ����Cu��OH��2 |
��1����ҵ�ϳ��÷���II�ͷ���III��ȡCu2O�������÷���I����ԭ���� ��
��2����֪��2Cu��s��+ ![]() O2��g��=Cu2O��s����H=��akJmol��1C��s��+
O2��g��=Cu2O��s����H=��akJmol��1C��s��+ ![]() O2��g��=CO��s����H=��bkJmol��1
O2��g��=CO��s����H=��bkJmol��1
Cu��s��+ ![]() O2��g��=CuO��s����H=��ckJmol��1
O2��g��=CuO��s����H=��ckJmol��1
��I�����ķ�Ӧ��2CuO��s��+C��s��=Cu2O��s��+CO��g����H=kJmol��1 ��
��3������II�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص�������ӦʽΪ ��
��4������IIIΪ������������Һ̬ƴ��N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2 �� ���Ʒ��Ļ�ѧ����ʽΪ ��
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺 2H2O��g�� ![]() 2H2��g��+O2��g����H��0
2H2��g��+O2��g����H��0
ˮ������Ũ����ʱ��t�仯�����ʾ��
��� | 0 | 10 | 20 | 30 | 40 | 50 | |
�� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
����������ȷ����������ĸ���ţ���
A.ʵ���¶ȣ�T1��T2
B.ʵ���ǰ20min��ƽ����Ӧ����v��O2��=7��10��5mol/��Lmin��
C.ʵ��ڱ�ʵ������õĴ���Ч�ʸ�
��6��25��ʱ����50mL0.018mol/L��AgNO3��Һ�м���50mL0.02mol/L���ᣬ���ɳ���������֪Ksp��AgCl��=1.8��10��10 �� ���ʱ��Һ�е�c��Ag+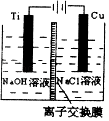
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� (����)
A.��ҵ��ȡ������������ɵ�SO2��ѭ������
B.���������ʶ���������,���ԺϽ�һ������ʴ
C.ɳ�ӡ�ʯӢ��ˮ����������������Ȼ���ڵĶ�������
D.��ҽ��������������������������ȱ����ƶѪ��ҩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������������ϵ���У�t��ʱ����ӦFeO��s��+CO��g��Fe��s��+CO2��g����ƽ�ⳣ��K=0.25����Ӧ�ﵽƽ��ʱn��CO����n��CO2��= �� ����1L�ܱ������м���0.02mol FeO��s������ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⣮��ʱFeO��s��ת����Ϊ50%����x= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С�齫6mol A�� 8mol B ����2L���ܱ������У�ij�¶��£������ķ�ӦΪA��g��+3B��g��C��g��+D��g����H=��49.0 kJmol��1 �� ���B�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��ʵ�ߣ��� 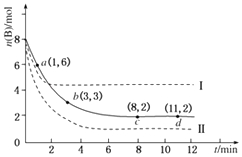
��1������ʱ���A��ƽ����Ӧ��������������ѡ����ĸ����ͬ������С���� ��
A��0��1min B��1��3min C��3��8min D��8��11min
��2��b�������Ӧ����������ڡ������ڡ���С�ڡ����淴Ӧ���ʣ�
��3��ƽ��ʱB��ת����Ϊ �� ���¶��µĻ�ѧƽ�ⳣ��K= ��
��4�����ı�ijһʵ�������ٽ�������ʵ�飬���B�����ʵ�����ʱ��仯��ͼ��������ʾ�������ߢ�ı�������� �� ���ߢ�ı�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C���ֲ�����ˮ�Ĺ��塣A��ijԪ�ص�һ�ֵ��ʣ�������������ȫȼ�յõ�һ����ɫ���壬��������ʹ�����ʯ��ˮ����ǣ����������������ܶ�Ϊͬ�¡�ͬѹ�µ������ܶȵ�1.375����B�����������ȿ�������Һ���������õ���Һ�м����������ʱ��������ɫ��״�������˳��������Ϊ������ˮ�İ�ɫ��ĩ������һ�ֱ�̼�����Ի������ᡣ��B��ʯ��ʯ�����������ϼ��Ⱥ��ܵõ�C��C�ڸ���ʱ�������̶��۵㡣
����������ʵ���ж�AΪԪ�صĵ��ʣ�B�Ļ�ѧʽΪ �� C����Ϊ��
д������C���йط�Ӧ�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͬ�¶Ⱥ�ѹǿ�£���������SO2��O2�����������Ϊ________�����Ӹ�����Ϊ________���ܶȱ�Ϊ________��
(2)�ڱ�״���£���CO��CO2��ɵĻ������Ϊ6.72 L������Ϊ12 g���˻������CO��CO2���ʵ���֮����________��CO�����������________��CO������������________��C��Oԭ�Ӹ�������________����������ƽ����Է���������________���ܶ���________g��L1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com