
【题目】有机物F( )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
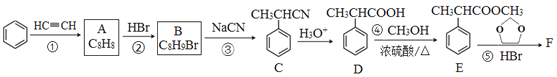
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。
的合成路线_________________。
【答案】 ![]() 16 酯基 ①②
16 酯基 ①②  乙二醇 23
乙二醇 23 
【解析】试题分析:根据C的结构简式,逆推B是![]()
;A是苯乙烯;  ,F是
,F是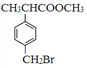 ,根据原子守恒,可知另一种产物是乙二醇;综合分析①②③④⑤分别是加成反应、加成反应、取代反应、取代反应、取代反应。
,根据原子守恒,可知另一种产物是乙二醇;综合分析①②③④⑤分别是加成反应、加成反应、取代反应、取代反应、取代反应。
解析:根据以上分析,(1)A是苯乙烯,结构简式为![]() ,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16 个原子共平面。
,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16 个原子共平面。
(2)E中官能团名称是酯基,①~④分别是加成反应、加成反应、取代反应、取代反应,属于加成反应的是①②。
(3)反应③的化学方程式为 。
。
(4) ,F是
,F是 ,根据原子守恒,可知另一种产物是乙二醇。
,根据原子守恒,可知另一种产物是乙二醇。
(5)①能与FeCl3溶液发生显色反应,说明含有酚羟基; ②能发生银镜反应,说明由醛基; ③分子中有1个甲基,满足以上条件的D的同分异构体有
,共23种。
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线。
的合成路线。![]() 与HCl取代反应生成
与HCl取代反应生成![]() ,
,![]() 与NaCN取代反应生成
与NaCN取代反应生成![]() ,
,![]() 水解为
水解为![]() ,最后
,最后![]()
与苯甲醇发生酯化反应生成![]() ,所以合成路线为
,所以合成路线为


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列物质或结构中含有糖类的是( )
①ATP ②DNA ③染色体 ④细胞膜 ⑤脂肪 ⑥淀粉酶
A. ①②③④ B. ①③④⑥ C. ①②③⑥ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于营养物质的说法中不正确的是
A.油脂制肥皂的原理是油脂发生碱性水解
B.碘酒可用于杀菌消毒是因为它能使蛋白质变性
C.鸡蛋清溶液中加入醋酸铅溶液,会因为盐析而沉淀
D.淀粉为人体提供能量,是因为淀粉水解生成葡萄糖,葡萄糖氧化释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
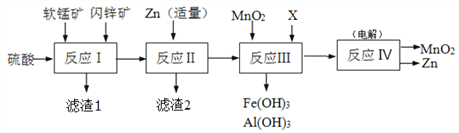
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL1mol/LNaCl溶液和50mL0.5mol/LMgCl2溶液中氯离子浓度前者与后者的关系为( )
A. 大于 B. 小于 C. 等于 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常压下,顺-2-丁烯的熔点比反—2—丁烯的熔点大
B. 按系统命名法,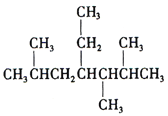 的名称为2,3,6—三甲基—4—乙基庚烷
的名称为2,3,6—三甲基—4—乙基庚烷
C. 肌醇 与葡萄糖
与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D. 1mol的 最多能与含3mol NaOH的水溶液完全反应
最多能与含3mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,测得1.92g RO2某气体的体积为672 mL。此气体的摩尔质量是_____________;R的相对原子质量为____________
(2)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为_______________。
(3)下列给出的条件中,无法确定该物质摩尔质量的是________。
A.已知气体在标准状况时的密度 B.已知物质的体积和质量
C.已知一定量物质的质量和物质的量 D.已知物质一个分子的实际质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com