

���� ��1�����������ӣ��ȼ����ᱵ�ų���������Ӹ��ţ����������������飻
��2�����̿���Ҫ�ɷ���MnO2�������������������ԭ��Ӧ��
��3��������Mn��OH��2��Ksp=4.5��10-13����MnSO4��Һ�еμӰ�ˮʹ��Һ��pH=10��c��OH-��=10-4mol/L��c��Mn2+��=$\frac{Ksp}{{c}^{2}��O{H}^{-}��}$��
��4����MnSO4•H2O�����ʵ���Ϊ1 mol��
��m��MnSO4•H2O��=1mol��169g•mol-1=169g��
������B��Ϊ�̵����������Mn��O��ԭ�Ӹ�����ȷ����ѧʽ��
��� �⣺��1������K2SO4��Ʒ�Ƿ����Ȼ������ʵ�ʵ�������ȡ������Ʒ���Թ��������Һ���μӹ���Ba��NO3��2��Һ��ȡ�ϲ���Һ�μ�AgNO3��Һ���۲��Ƿ��а�ɫ������ȷ����
�ʴ�Ϊ��ȡ������Ʒ���Թ��������Һ���μӹ���Ba��NO3��2��Һ��ȡ�ϲ���Һ�μ�AgNO3��Һ��
��2�����̿���Ҫ�ɷ���MnO2�������������������ԭ��Ӧ����ӦIV�Ļ�ѧ����ʽΪMnO2+SO2=MnSO4��
�ʴ�Ϊ��MnO2+SO2=MnSO4��
��3��������Mn��OH��2��Ksp=4.5��10-13����MnSO4��Һ�еμӰ�ˮʹ��Һ��pH=10��c��OH-��=10-4mol/L��c��Mn2+��=$\frac{Ksp}{{c}^{2}��O{H}^{-}��}$=$\frac{4.5��1{0}^{-13}}{��1{0}^{-4}��^{2}}$=4.5��10-5mol/L��
�ʴ�Ϊ��4.5��10-5��
��4����MnSO4•H2O�����ʵ���Ϊ1 mol��
��m��MnSO4•H2O��=1mol��169g•mol-1=169g��
������B��Ϊ�̵������������Ϊm�������=169 g��0.4517=76.34g��
����n��Mn��=1mol��m��Mn��=1mol��55g•mol-1=55g��
��$n��O��=\frac{76.34g-55g}{{16g•mo{l^{-1}}}}=\frac{4}{3}mol$��
n��Mn����n��O��=1 mol��$\frac{4}{3}$mol=3��4��
���B������ʾ���ʵĻ�ѧʽΪMn3O4��
��������B������ʾ���ʵĻ�ѧʽΪMn3O4��
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬�������Ӽ��顢������ԭ��Ӧ���ܶȻ������Ϊ���Ĺؼ������ط�����ʵ�顢���������Ŀ��飬��Ŀ�Ѷ��еȣ�


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ��Ԫ����Z���⻯���ȶ������ | |
| B�� | ԭ�Ӱ뾶��X��Y�����Ӱ뾶��X+��Z2- | |
| C�� | ͬ����Ԫ����X�Ľ�������ǿ | |
| D�� | ͬ����Ԫ����Y����ۺ������������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ���� ���� | B�� |  ���� ���� | C�� |  ˮ ˮ | D�� |  ������̼ ������̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
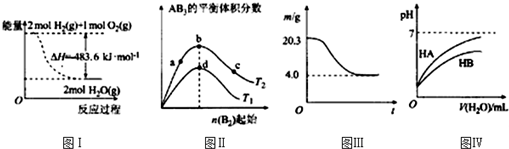
| A�� | ͼ���ʾH2��O2������Ӧ�����е������仯����H2��ȼ���ȡ�H=-241.8 kJ•mol-1 | |
| B�� | ͼ���ʾ��ӦA2��g��+3B2��g��?2AB3��g�����ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c | |
| C�� | ͼ���ʾ0.1mol MgCl2•6H2O�ڿ����г�ּ���ʱ����������ʱ��ı仯 | |
| D�� | ͼ����ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pH����ͬŨ��NaB��Һ��pH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��PAN���ȶ�����Ⱦ�
��PAN���ȶ�����Ⱦ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
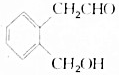 ��A���Ա�����Cu��OH��2����ΪB��B����Ũ������ںͼ���ʱ���������ڵ�������Ӧ����C��C��������һ����������Ԫ�����ش��������⣺
��A���Ա�����Cu��OH��2����ΪB��B����Ũ������ںͼ���ʱ���������ڵ�������Ӧ����C��C��������һ����������Ԫ�����ش��������⣺ ��
�� +2Cu��OH��2$\stackrel{��}{��}$
+2Cu��OH��2$\stackrel{��}{��}$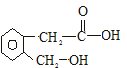 +Cu2O��+2H2O��
+Cu2O��+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com