
【题目】辣椒的味道主要来自辣椒素类化合物。一种合成辣椒素中间体![]()
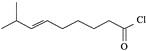
![]() 的合成路线如下:
的合成路线如下:
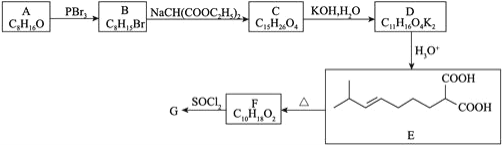
回答下列问题:
![]() 中所含官能团的名称为_____________。
中所含官能团的名称为_____________。
![]() 的结构简式为______________________。
的结构简式为______________________。
![]() 、
、![]() 的反应类型分别是______________、______________。
的反应类型分别是______________、______________。
![]() 的化学方程式为___________________________。
的化学方程式为___________________________。
![]() 满足下列条件的E的同分异构体有________种
满足下列条件的E的同分异构体有________种![]() 不考虑立体异构
不考虑立体异构![]() 。
。
![]() 含有一个六元碳环
含有一个六元碳环![]() 环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
![]() 参照上述合成路线,以1,
参照上述合成路线,以1,![]() 丁二烯和
丁二烯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备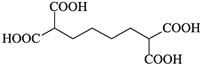 的合成路线_______________。
的合成路线_______________。
【答案】碳碳双键、羧基 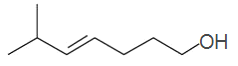 取代反应
取代反应![]() 或水解反应
或水解反应![]() 取代反应
取代反应 ![]() +2KOH
+2KOH![]()
![]() +2C2H5OH 12
+2C2H5OH 12 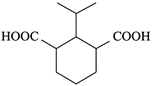

![]()
![]()
![]()
![]()
![]()
【解析】
根据反应条件可以分析,![]() 是醇的溴代,
是醇的溴代,![]() 是卤代烃的取代反应,
是卤代烃的取代反应,![]() 是酯的水解,则根据E的结构可以推出D为:
是酯的水解,则根据E的结构可以推出D为: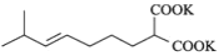 ,C为:
,C为: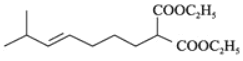 ,B为:
,B为: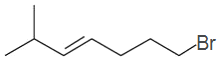 ,A为:
,A为: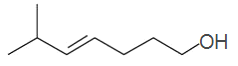 ,
,![]() 是脱羧反应,脱去一个羧基,据此解答。
是脱羧反应,脱去一个羧基,据此解答。
![]() 中所含官能团的名称为碳碳双键、羧基;故答案为:碳碳双键、羧基;
中所含官能团的名称为碳碳双键、羧基;故答案为:碳碳双键、羧基;
![]() 由分析可知A的结构简式为:
由分析可知A的结构简式为: ,
,
故答案为: ;
;
![]() 是酯的水解、
是酯的水解、![]() 是羧基转化为酰氯,反应类型均为取代反应,
是羧基转化为酰氯,反应类型均为取代反应,
故答案为:取代反应![]() 或水解反应
或水解反应![]() 、取代反应;
、取代反应;
![]() 的转化是酯在碱性条件的水解,化学方程式为:
的转化是酯在碱性条件的水解,化学方程式为:![]() ,
,
故答案为:![]() ;
;
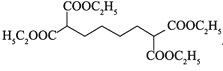
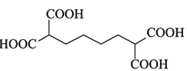
![]() 的分子式为:
的分子式为:![]() ,不饱和度为3,
,不饱和度为3,![]() 含有一个六元碳环
含有一个六元碳环![]() 环上三个碳原子分别连有一个取代基且其中两个为羧基,根据不饱和度可知环应是环己烷的结构,除去2个羧基,则另一个取代基是丙基,注意丙基有正丙基和异丙基两种。2个羧基在环己烷上的位置关系有:
环上三个碳原子分别连有一个取代基且其中两个为羧基,根据不饱和度可知环应是环己烷的结构,除去2个羧基,则另一个取代基是丙基,注意丙基有正丙基和异丙基两种。2个羧基在环己烷上的位置关系有:![]() 、
、![]() 、
、![]() ,3种情况下,丙基的位置分别有:2、3、1种,共6种,则两种丙基共有12种位置关系。其中核磁共振氢谱有7组峰的结构简式为:
,3种情况下,丙基的位置分别有:2、3、1种,共6种,则两种丙基共有12种位置关系。其中核磁共振氢谱有7组峰的结构简式为: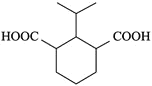 和
和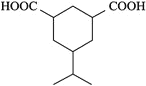 ,
,
故答案为:12; 和
和 ;
;
![]() 类比流程图中
类比流程图中![]() 可知,以1,
可知,以1,![]() 丁二烯和
丁二烯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备 的合成路线为:
的合成路线为:![]()
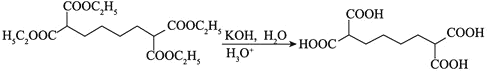 ,
,
故答案为:![]()
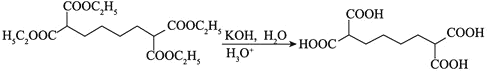 。
。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,根据表中提供的有关信息,回答问题:
元素 | 相关信息 |
A | 所有单质中密度最小 |
B | 形成化合物种类最多的元素 |
D | 基态原子中只有3个能级,有2个未成对电子 |
E | 短周期中原子半径最大 |
F | 第三周期中电负性最大的元素 |
G | 最外层只有一个电子,内层填满电子 |
(1)E元素在周期表中的位置是______,F元素原子最外层电子排布式为______,BD2的立体构型为______。
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性,用离子方程式表示其显碱性的原因:______。
(3)氢化物稳定性:B______D;最高价氧化物对应的水化物酸性:C______F。(填“<”或“>”)
(4)每个B2A4分子中含有______个σ键,______个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子核外电子排布式为1s22s22p3,下列说法正确的是( )
A.该原子的核外电子排布图为![]()
B.该原子核外有3种能量不同的电子
C.该原子核外最外层上有3种运动状态不同的电子
D.该原子核外最外层电子占据3个原子轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
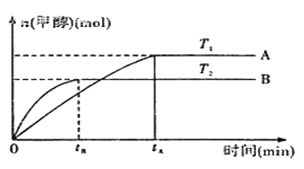
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜
醋酸二氨合铜![]() Ⅰ
Ⅰ![]() ,氨水
,氨水![]() 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和![]() 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为:![]() ; 完成下列填空:
; 完成下列填空:
![]() 如果要提高上述反应的反应速率,可以采取的措施是 ______
如果要提高上述反应的反应速率,可以采取的措施是 ______ ![]() 选填编号
选填编号![]()
![]() 减压
减压 ![]() 增加
增加![]() 的浓度
的浓度 ![]() 升温
升温 ![]() 及时移走产物
及时移走产物
![]() 铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
![]() 简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤![]() 注明吸收和再生的条件
注明吸收和再生的条件![]() .______
.______
![]() 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
![]() 已知
已知![]() 与
与![]() 分子结构相似,
分子结构相似,![]() 的电子式是 ______
的电子式是 ______ ![]() 熔点高于
熔点高于![]() ,其原因是 ______
,其原因是 ______
![]() 提取的
提取的![]() 中含少量
中含少量![]() 、
、![]() 将产品溶解,加入
将产品溶解,加入![]() ,加热至沸,再加入
,加热至沸,再加入![]() 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______ ![]() 滤渣的主要成分是 ______ 、 ______ .
滤渣的主要成分是 ______ 、 ______ .
![]() 称取
称取![]() 小苏打样品
小苏打样品![]() 含少量
含少量![]() ,配置成250mL溶液,取
,配置成250mL溶液,取![]() 用
用![]() 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸![]() 实验中所需的定量仪器出滴定管外,还有 ______
实验中所需的定量仪器出滴定管外,还有 ______ ![]() 选甲基橙而不选酚酞作为指示剂的原因是 ______
选甲基橙而不选酚酞作为指示剂的原因是 ______ ![]() 样品中
样品中![]() 质量分数为 ______
质量分数为 ______ ![]() 保留3位小数
保留3位小数![]()
![]() 将一定量小苏打样品
将一定量小苏打样品![]() 含少量
含少量![]() 溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______
溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______ ![]() 选填“偏高”、“偏低”或“不受影响”
选填“偏高”、“偏低”或“不受影响”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得
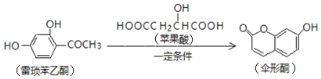
下列说法中正确的是( )
A.一分子反应物雷琐苯乙酮含有3个碳碳双键
B.苹果酸的一种缩聚产物是![]()
C.1mol产物伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A. A的离子结构示意图为![]()
B. D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C. E和D形成的离子化合物ED2的电子式为![]()
D. B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com