
【题目】现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏B.分液、蒸馏、萃取
C.萃取、蒸馏、分液D.蒸馏、萃取、分液
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)画出磷原子的原子结构示意图:______。
(2)写出H2S分子的电子式:________。
(3)写出表示含有8个质子,10个中子的原子的化学符号:______。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a=____。
(5)用电子式表示氯化镁的形成过程:____。
(6)写出Na2O2中所含化学键的类型______。
(7)拆开1mol H—H键,1mol N—H键, 1mol![]() 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
(8)利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:___;正极__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,25 ℃时几种弱酸的电离常数如表所示:
弱酸 | 电离常数 | 弱酸 | 电离常数 |
H2CO3 | Ka1=4.3×10-7 Ka2=5.6×10-11 | H2C2O4 (草酸) | Ka1=5.9×10-2 Ka2=6.4×10-5 |
H3PO4 | Ka1=7.1×10-3 Ka2=6.3×10-8 Ka3=4.2×10-13 | H3C6H5O7 (柠檬酸) | Ka1=7.4×10-4 Ka2=1.7×10-5 Ka3=4.0×10-7 |
下列有关推断正确的是( )
A. 溶液pH的大小关系为K3PO4>K2HPO4>KH2PO4
B. 在Na2CO3溶液中存在:c(OH-)- c(H+)=c(HCO3-)+ c(H2CO3)
C. 等浓度的NaHCO3、NaHC2O4溶液中前者pH较大
D. H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________________________ 。
(2)表中能形成两性氢氧化物的元素是 ________ (/span>用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ________________________ 。
(3)④元素与⑦元素形成化合物的电子式 _____________________________ 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ____(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
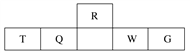
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。

(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:甲:![]() 乙:
乙:![]() 其中能表明甲、乙容器中反应都达到平衡状态的是
其中能表明甲、乙容器中反应都达到平衡状态的是
A. 恒温时,气体压强不再改变
B. 断裂氢氧键速率是断裂氢氢键速率的2倍
C. 混合气体密度不变
D. 单位时间内,消耗水蒸气质量与生产氢气质量比为9:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com