
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |


科目:高中化学 来源: 题型:
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中的溶解度:碳酸钠>碳酸氢钠 |
| B、热稳定性:碳酸钠>碳酸氢钠 |
| C、溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH |
| D、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
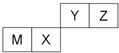
| A、Z位于元素周期表中第2周期、第ⅥA族 |
| B、原子半径Z<M |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、X的最简单气态氢化物的热稳定性比Z的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
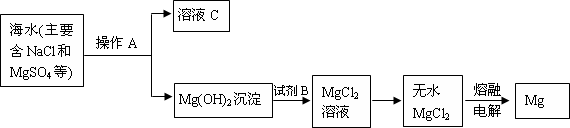
查看答案和解析>>
科目:高中化学 来源: 题型:
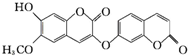 西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )
西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )| A、分子中所有原子可以处于同一平面 |
| B、该物质能发生加成、氧化、水解、消去等反应 |
| C、能与FeCl3溶液发生显色反应 |
| D、1 mol该有机物最多可与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水稀释10倍后,pH=4 |
| B、加水稀释后,溶液中c(H+)和c(OH-)均减少 |
| C、加入醋酸钠晶体后,溶液的pH增大 |
| D、加入等体积pH=11的NaOH溶液后,溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com