
| A. | 电路中共转移0.7mol电子 | |
| B. | 阴极得到的气体物质的量为0.35mol | |
| C. | 阴极质量增加3.2g | |
| D. | 铝元素以A1(OH)3的形式存在 |
分析 混合溶液中阳极上Cl-先放电生成Cl2,然后OH-放电生成O2,阴极上Cu2+先放电生成Cu,然后H+放电生成H2,
溶液中根据Cl原子守恒得n(Cl-)=3n(AlCl3)+2n(CuCl2)=0.1mol×(3+2)=0.5mol,根据Cu原子守恒得n(Cu2+)=n(CuCl2)=0.1mol;
用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同,说明两个电极上生成气体物质的量相等,
因为每个氯离子失去一个电子、每个氢离子得到一个电子,所以要使两个电极得到相同物质的量的气体,阳极上应该还有氧气生成,
设生成气体总物质的量为xmol,
根据转移电子守恒得0.5mol×1+(x-0.25)mol×4=0.1mol×2+2xmol,
x=0.35;
A.根据阳极上生成气体与转移电子关系计算转移电子物质的量;
B.根据以上分析确定阴极上生成气体物质的量;
C.阴极上质量增加量为Cu的质量;
D.电解后溶液呈酸性.
解答 解:混合溶液中阳极上Cl-先放电生成Cl2,然后OH-放电生成O2,阴极上Cu2+先放电生成Cu,然后H+放电生成H2,溶液中根据Cl原子守恒得n(Cl-)=3n(AlCl3)+2n(CuCl2)=0.1mol×(3+2)=0.5mol,根据Cu原子守恒得n(Cu2+)=n(CuCl2)=0.1mol;
用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同,说明两个电极上生成气体物质的量相等,
因为每个氯离子失去一个电子、每个氢离子得到一个电子,所以要使两个电极得到相同物质的量的气体,阳极上应该还有氧气生成,
设生成气体总物质的量为xmol,
根据转移电子守恒得0.5mol×1+(x-0.25)mol×4=0.1mol×2+2xmol,
x=0.35;
A.转移电子物质的量=0.5mol×1+(0.35-0.25)mol×4=0.9mol,故A错误;
B.根据以上分析知,阴极上生成气体物质的量为0.35mol,故B正确;
C.阴极上质量增加量为Cu的质量,根据Cu原子守恒得n(Cu)=n(CuCl2)=0.1mol,m(Cu)=0.1mol×64g/mol=6.4g,故C错误;
D.阳极上第一段电解生成氯气、第二段电解生成氧气,阴极上第一段电解生成Cu、第二段电解生成氢气,所以相当于第一段电解氯化铜、第二段电解HCl、第三段电解H2O,电解后溶液呈酸性,铝元素以铝离子存在,故D错误;
故选B.
点评 本题以电解原理为载体考查混合物的有关计算,明确各个电极上放电离子顺序是解本题关键,知道整个过程相当于电解氯化铜、电解HCl、电解水三个阶段,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
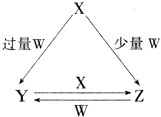 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量镁粉的Fe2(SO)3溶液 | |
| B. | FeCl2溶液与稀硝酸混合后的溶液 | |
| C. | 铁丝在足量的氯气中燃烧后所得产物的溶液 | |
| D. | 长期暴露在空气中的绿矾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、K、HCl | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+ | |
| D. | 电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com