
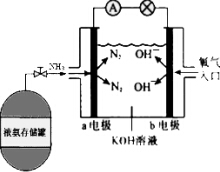
 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题. 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:填空题
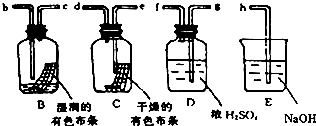
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气所含有的原子数目为NA | |
| B. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| C. | 0.5 mol单质铁与足量盐酸反应转移电子数为NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com