
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
分析 ①将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,则甲只能是Ba(OH)2;
②0.1mol/L乙溶液的pH<1,则c(H+)>0.1mol/L,说明乙是硫酸;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,则丁是NH4HCO3;
根据以上分析进行判断.
解答 解:根据②中的信息可知乙是二元酸,故乙是H2SO4;根据③中现象,可以推知丙中含有Cl-;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,
则可推出:甲是Ba(OH)2,乙是H2SO4,丙是MgCl2,丁是NH4HCO3,
A.甲是Ba(OH)2,则碱溶液中不含HCO3-,故A错误;
B.乙是H2SO4,则乙溶液中含有SO42-,故B正确;
C.丙是MgCl2,则丙溶液中含有Mg2+,故C正确;
D.丁是NH4HCO3,则丁中含有NH4+,故D正确;
故选A.
点评 本题考查常见离子的性质及检验方法,题目难度中等,做题时注意题中的反应现象,找出突破口,抓住物质的性质是关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 氢氧化钡晶体的粉末和稀硫酸混合 | D. | 木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | BaO2是离子化合物,但含有非极性共价键,晶体中阴阳离子个数相等. | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | 电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
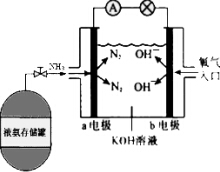 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 液氨电离达到平衡时,各微粒的浓度保持不变 | |
| C. | 只要不加入其它物质c(NH4+)=c(NH2-) | |
| D. | 液氨中存在NH3、NH4+、NH2-、H2O、NH3•H2O等粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中,元素所在的族序数等于原子的最外层电子数 | |
| B. | 同主族元素,随原子序数的增大,原子半径增大,主要原因是核电荷数增大 | |
| C. | 第二周期元素随原子序数的递增,元素原子的第一电离能依次递增 | |
| D. | 第 VIIA族元素从上到下,元素电负性逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com