
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH4+)=c(Cl-) B.若a>b,则c(NH4+)>c(Cl-)
C.若a>b,则c(OH-)>c(H+) D.若a<b,则c(OH-)<c(H+)
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Al(s)+2O3(g)=2Al2O3(s) ΔH2
3O2(g)=2O3(g) ΔH3 则ΔH1、ΔH2、ΔH3的关系正确的是
A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
把0.05molNaOH固体分别加入到100ml下列溶液中,溶液导电性基本不变的是
A.自来水 B.0.5mol/L盐酸
C.0.5mol/L醋酸 D.0.5mol/L氨水
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c(Na2CO3)<c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,离子浓度的关系:c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
某同学为完成 2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验如图所示你认为可行的是
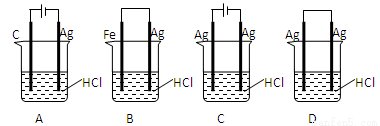
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
纳米钴(Co)是加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:填空题
(14分)元素X、Y、Z、W、M、N原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是__________________________,X、Y、Z、W、M的原子半径由大到小的顺序为:_______________(用元素符号表示)。
(2)写出Y2X2的电子式____________;Z2X4结构式 _______________。
(3)X、Z、W形成的化合物,水溶液一定显酸性的盐是______________,其原因是_____________(用离子方程式表示),该物质所含化学键的类型是_____________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为_______________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式___________________。
(6)写出N W2通入硝酸钡溶液中的离子方程式 ______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:填空题
(15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.4 | 8.0 |
请回答下列问题:
①步骤III的操作名称是 。
②下列试剂中,可以作为试剂a的是 。
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行? (填“是”或“否”),理由是 。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H = 。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是 。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g·L-1;Y、M、W的最高价氧化物的水化物。两两间都能发生反应。下列说法不正确的是
A.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
B.含有W阳离子的某种盐,可用作净水剂
C.M的单质可保存于煤油中
D.由X、Y、Z 种元素形成的某种化合物的水溶液,可能呈碱性或酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com