
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如下图所示,E1表示反应A+B→X的活化能。 下列有关叙述正确的是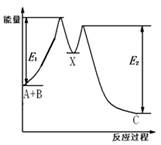
| A.E2表示反应X→C的活化能 |
| B.反应A+B→C的△H<0 |
| C.X是反应A+B→C的催化剂 |
| D.加入催化剂可改变反应A+B→C的焓变 |
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:单选题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为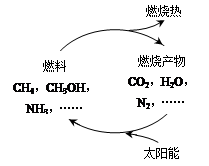
| A.化学能 | B.热能 |
| C.生物能 | D.电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.右图可表示水分解过程中的能量变化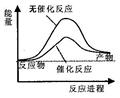 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是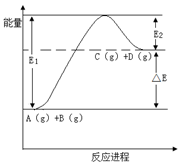
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,△E减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是 ( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=–2986kJ·mol-1
4P(s,红磷)+ 5O2=P4O10(s);ΔH=–2956kJ·mol-1
则白磷比红磷 (填“稳定”或“不稳定”)
(4) 已知一定条件下A2与B2自发反应生成AB3,则反应
A2(g)+3B2(g)=2AB3(g) 的ΔS= 0,ΔH 0 (填“<”、“>”、“=”)
(5)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗 银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com