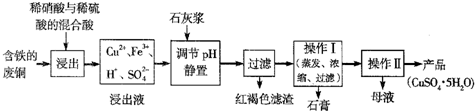
某化学小组在实验室模拟用软锰矿(主要成分MnO
2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
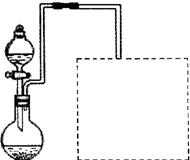
①缓慢向烧瓶中(见图a)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO
2+H
2O=H
2SO
3MnO
2+H
2SO
3=MnSO
4+H
2O
(铁浸出后,过量的SO
2会将Fe
3+还原为Fe
2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO
2粉末.
③再用Na
2CO
3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH
4HCO
3,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰.
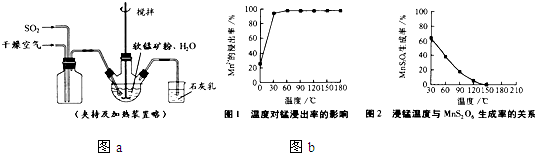
回答:
(1)“浸锰”反应中往往有副产物MnS
2O
6的生成,温度对“浸锰”反应的影响如图b,为减少MnS
2O
6 的生成,“浸锰”的适宜温度是
.
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是
.②中加入一定量纯MnO
2粉末的主要作用是
,相应反应的离子方程式为
.
表1:生成相应氢氧化物的pH
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
8.3 |
4.7 |
| 完全沉淀pH |
3.7 |
9.6 |
9.8 |
6.7 |
(3)③中所得的滤液中含有Cu
2+,可添加过量的难溶电解质MnS除去Cu
2+,经过滤,得到纯净的MnSO
4.用平衡移动原理解释加入MnS的作用
.
(4)④中加入NH
4HCO
3后发生反应的离子方程式是
.
(5)检验④中沉淀是否洗涤干净的方法是
.