
(8��)���ڿ���������������Ҫ��Ӧ�á�ij��ȤС����0.50mol��L-1 KI ��0.2��������Һ ��0.20mol��L-1 K2S2O8 ��0.10mol��L-1 Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣��֪S2O82��+2I��=2SO42��+I2 (��) I2 +2S2O32��=2I��+S4O62�����죩
��1����KI ��Na2S2O3����۵Ļ����Һ�м���һ������K2S2O8 ��Һ������Һ�� ��д���ӷ��ţ��ľ�����Һ��ɫ������ɫ��Ϊ��ɫ��Ϊȷ���ܹ۲쵽��ɫ��S2O32����S2O82����ʼ�����ʵ���������Ĺ�ϵΪn��S2O32�����Un��S2O82���� ��
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
|
ʵ�� ��� |
���/mL |
||||
|
K2S2O8��Һ |
ˮ |
KI��Һ |
Na2S2O3��Һ |
������Һ |
|
|
�� |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
|
�� |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
|
�� |
8.0 |
VX |
4.0 |
4.0 |
2.0 |
����VX= mL�������� ��
��ÿ�ո�2�֣���1��S2O32�� �� ��2
��2��2.0 �� ������Һ��������䣬���ı�S2O82����Ũ�ȶ��������ʵ�Ũ�Ȳ���
����������1����Һ��ɫ������ɫ��Ϊ��ɫ��˵����Һ���е��ʵ����ɡ����Ը��ݷ�ӦS2O82��+2I��=2SO42��+I2 (��)��I2 +2S2O32��=2I��+S4O62�����죩��֪����ʱS2O32�� �Ѿ�������ϡ����ݷ���ʽ��֪��ǡ�÷�Ӧʱn��S2O32�����Un��S2O82������2�U1������Ҫ�ܹ۲쵽��ɫ����n��S2O32����Ҫ���㣬��n��S2O32�����Un��S2O82������2�U1��
��2��Ҫ̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬����Һ�����������ͬ�����ݢ٢ڿ�֪����Һ���������20ml��Ψһ��ͬ����S2O82�������ʵ���������VX=2.0ml��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ڿ���������������ҪӦ�ã�ij��ȤС����0.50mol?L-1KI��0.2%������Һ��0.20mol?L-1K2S2O8��0.10mol?L-1Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�죮
���ڿ���������������ҪӦ�ã�ij��ȤС����0.50mol?L-1KI��0.2%������Һ��0.20mol?L-1K2S2O8��0.10mol?L-1Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�죮| 0.20mol?L-1K2S2O8��Һ�����/mL | 0.10mol?L-1Na2S2O3��Һ�����/mL | H2O�����/mL | 0.50mol?L-1KI��Һ����� | ������Һ | |
| ʵ��1 | 10.0 | 4.0 | 0.0 | 4.0 | 2.0 |
| ʵ��2 | 9.0 | 4.0 | 1.0 | 4.0 | 2.0 |
| ʵ��3 | 8.0 | 4.0 | V1 | 4.0 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�� ��� |
���V/ml | ||||
| K2S2O8��Һ | ˮ | KI��Һ | Na2S2O3��Һ | ������Һ | |
| �� | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| �� | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| �� | 8.0 | Vx | 4.0 | 4.0 | 2.0 |

| ��H1-��H2 |
| 2 |
| ��H1-��H2 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�����ʡ��������У��һ��ѧ�ڵ��Ĵ�������ѧ�Ծ����������� ���ͣ�ʵ����
(8��)���ڿ���������������Ҫ��Ӧ�á�ij��ȤС����0.50mol��L-1KI ��0.2��������Һ��0.20mol��L-1K2S2O8��0.10mol��L-1 Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣��֪S2O82��+2I��=2SO42��+I2 (��) I2 +2S2O32��=2I��+S4O62�����죩
��1����KI ��Na2S2O3����۵Ļ����Һ�м���һ������K2S2O8��Һ������Һ�� ��д���ӷ��ţ��ľ�����Һ��ɫ������ɫ��Ϊ��ɫ��Ϊȷ���ܹ۲쵽��ɫ��S2O32����S2O82����ʼ�����ʵ���������Ĺ�ϵΪn��S2O32�����Un��S2O82���� ��
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
| ʵ�� ��� | ���/mL | ||||
| K2S2O8��Һ | ˮ | KI��Һ | Na2S2O3��Һ | ������Һ | |
| �� | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| �� | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| �� | 8.0 | VX | 4.0 | 4.0 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ������������У����12���¿���ѧ�Ծ��������棩 ���ͣ������
����12�֣����ڿ���������������ҪӦ�á�ij��ȤС����0.50mol��L-1KI��0.2��������Һ��0.20mol��L-1K2S2O8��0.10mol��L-1Na2S2O3���Լ���̽����Ӧ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��֪��S2O82-+2I-==2SO42- +I2������ I2+2 S2O32-==2I- ��S4O62- ���죩
��1����KI��Na2S2O3����۵Ļ����Һ�м���һ������K2S2O8��Һ������Һ�е�__________�ľ�����Һ��ɫ������ɫ���Ϊ��ɫ��Ϊȷ���ܹ۲쵽��ɫ��S2O32-��S2O82-��ʼ�����ʵ���������Ĺ�ϵΪ��n(S2O32-):n(S2O82-)_______��

��2��Ϊ̽�ַ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
����Vx=_______________mL��������___________________��
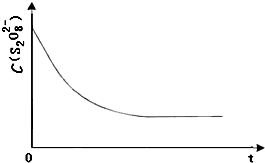
��3����֪ij�����£�Ũ��c(S2O82-)����Ӧʱ��t�ı仯������ͼ13�������������������䣬���ڴ������ͼ�У��ֱ����ͷ�Ӧ�¶Ⱥͼ������ʱc(S2O82-)��t�ı仯����ʾ��ͼ��������Ӧ�ر�ע��

��4����Ҳ����������������Դ��﮵��صIJ��ϡ��õ�ط�ӦΪ��
2Li��s��+I2��s��=2LiI��s�� ��H
��֪��4Li��s��+O2��g��=2Li2O��s�� ��H1
4LiI��s��+O2��g��=2I2��s��+2Li2O��s�� ��H2
���ط�Ӧ�ġ�H=_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com