
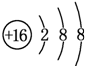 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为 .
.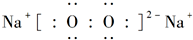 .
. 分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca,Y为Cl;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,属于共价化合物;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气在加热条件下反应生成Na2O2.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca,Y为Cl,Ca元素在周期表中位置:第四周期第IIA族,
故答案为:第四周期第IIA族;CaCl2;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,S2-离子结构示意图是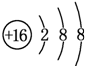 ;
;
E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,电子式为 ,
,
故答案为: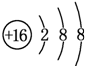 ;S=C=S;
;S=C=S; ;
;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气在加热条件下反应生成Na2O2,其电子式为: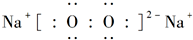 ,
,
故答案为: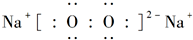 .
.
点评 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出了元素周期律 | B. | 开发了合成氨的生产工艺 | ||
| C. | 揭示了燃烧的本质 | D. | 提取了治疟药物青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性小于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素④⑥形成的化合物具有两性 | |
| D. | 元素④⑥⑧的最高价氧化物的水化物两两之间皆能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
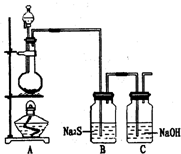 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲的非金属性最强 | |
| B. | 戊的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径大小为:乙>丙>甲 | |
| D. | 乙分别与甲、丙形成晶体M、N的熔点大小为:M<N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com