
| A. | 甲的非金属性最强 | |
| B. | 戊的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径大小为:乙>丙>甲 | |
| D. | 乙分别与甲、丙形成晶体M、N的熔点大小为:M<N |
分析 甲、乙、丙、丁、戊均为短周期主族元素,甲的原子半径是第二周期中最小的,则甲为F元素;乙的单质能跟冷水剧烈反应产生氢气,则乙为Na;丙原子核外p电子比s电子多5个,原子只能有3个电子层,核外电子排布为1s22s22p63s23p5,故丙为Cl;丁和丙在同周期,丁的最高价为+4价,则丁为Si;戊的单质是气体,其密度介于H2和O2的密度之间,则戊为N元素.
解答 解:甲、乙、丙、丁、戊均为短周期主族元素,甲的原子半径是第二周期中最小的,则甲为F元素;乙的单质能跟冷水剧烈反应产生氢气,则乙为Na;丙原子核外p电子比s电子多5个,原子只能有3个电子层,核外电子排布为1s22s22p63s23p5,故丙为Cl;丁和丙在同周期,丁的最高价为+4价,则丁为Si;戊的单质是气体,其密度介于H2和O2的密度之间,则戊为N元素.
A.甲为F元素,是非金属性最强的元素,故A正确;
B.戊的最高价氧化物的水化物为硝酸,无机含氧酸中高氯酸的酸性最强,故B错误;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径乙(Na)>丙(Cl)>甲(F),故C正确;
D.乙分别与甲、丙形成晶体M可以为NaF、N为NaCl,均属于离子化合物,氟离子半径小于氯离子半径,故氟化钠的晶格能更大,则氟化钠的熔点高于氯化钠的,故D错误.
故选:BD.
点评 本题考查结构性质物质关系应用,关键是推断元素,注意理解掌握元素周期律与物质熔沸点的比较.


科目:高中化学 来源: 题型:解答题
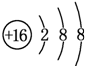 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为 .
.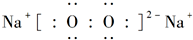 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与NaOH溶液反应 | B. | KNO3加入水中 | ||
| C. | NH4NO3加入水中 | D. | CaO加入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |  |
| A | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
| C | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
| D | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

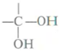 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
.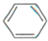 +
+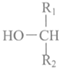 $\stackrel{酶}{→}$
$\stackrel{酶}{→}$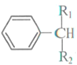 +H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式
+H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式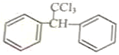 .
.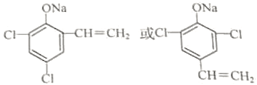 (任写一种)
(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
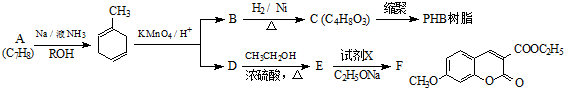
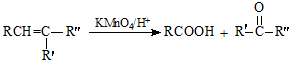
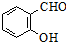 +
+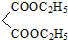 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$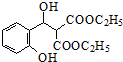 $\stackrel{△}{→}$
$\stackrel{△}{→}$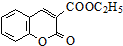
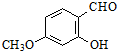 .
.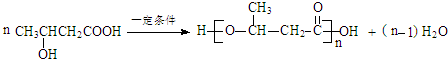 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
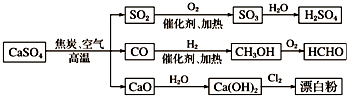
| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH,原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 改变条件 | 平衡移动方向 | 体系内混合气体的颜色变化 |
| (1)加入氢气 | 正反应方向 | 变浅 |
| (2)升高温度 | 逆反应方向 | 变深 |
| (3)加入碘 | 正反应方向 | 变深 |
| (4)使容器的容积压缩到原来的一半 | 不移动 | 变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com