
【题目】现有可逆反应2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
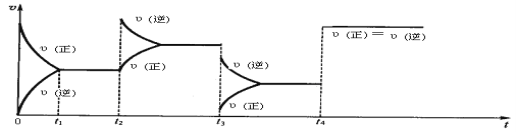
t2:___________________;t3:______________________ ;t4:______________________。
已知:A(g) + 2B(g) ![]() 2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
K值会______(增大、减小、不变),A的转化率______________,化学反应速率________________。
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
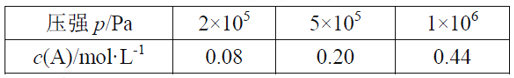
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,如图为用一定物质的量浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的

A | B | C | D | |
X/mol·L-1 | 0.12 | 0.09 | 0.04 | 0.03 |
Y/mol·L-1 | 0.04 | 0.03 | 0.12 | 0.09 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4mol A气体和 2mol B气体在 2L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得 C 的浓度为 0.6 molL-1,现有下列几种说法,其中正确的是
A. 用物质A表示的反应的平均速率为0.2 molL-1s-1 B. 2s时物质B的浓度为0.7 molL-1
C. 用物质B表示的反应的平均速率为0.1 molL-1s-1 D. 2s时物质A的转化率为70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

已知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl2、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)NaH2PO2中P的化合价为___________。
(2)“酸浸”过程中SbCl3和Sb2S3反应有S生成,该反应的还原产物是___________(填化学式)。
(3)写出“还原”反应的化学方程式:_________________________________。
(4)已知:浸出液中C(Cu2+)=0.01mo/L、C(Pb2+)=0.1mo/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是______________________(填化学式);当CuS、PbS共沉时,![]() ___________。
___________。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂还原剂的物质的量之比为_______。常温下,SbCl2溶液的pH<7,用离子方程式表示其原因:_____________________。
(6)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______________________;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是
2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是

A. 反应中硫元素既体现氧化性又体现还原性
B. 装置Ⅰ中可以观察到出现白色沉淀,其主要成分是BaSO4和BaSO3
C. 装置Ⅱ中可以观察到高锰酸钾紫色褪去
D. 将装置Ⅰ、Ⅱ顺序交换,仍能观察到相同的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 干冰升华B. 酸碱中和
C. 天然气燃烧D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com