
【题目】将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108
B.108:35.5
C.8:1
D.1:2
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成题目:
(1)Ⅰ含氮的化合物在化学反应中变化复杂.现用如图3所示仪器(夹持装置己省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O
②气体液化的温度:NO2 21℃、NO﹣152℃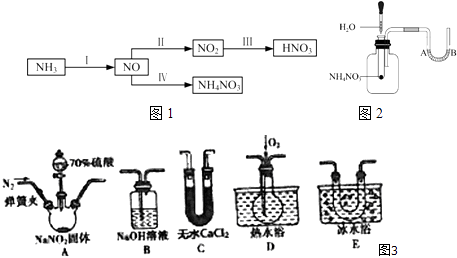
a.为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为
b.反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
c.在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体.
①盛装70%浓硫酸的仪器名称是
②实验确认有NO的现象是
d.通过上述实验探究过程,可得出装置A中反应的化学方程式是 .
(2)Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3 , 如图1所示.【资料卡片】
①NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
②在230℃以上时,同时有弱光:2NH4NO3=2N2↑+O2↑+4H2O
③在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+2NO2↑+8H2O
a.如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因 .
b.实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是(填“能”或“不能”)用硝酸铵代替氯化铵.
c.在汽车发生碰撞时,NaN3会产生(填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度.
d.完成离子反应IV:NO+H2O=++H+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
序号 | 电解质 | 酸 | 氧化物 | 单质 | 酸性氧化物 |
A | Cl2 | FeBr2 | CO | Hg(汞) | FeCl3 |
B | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
C | KClO3 | HCl | CaO | Cl2 | CO2 |
D | K2O | HCl(浓) | H2O | Cl2 | MnO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2与SO3,下列说法正确的是( )
A.硫元素的质量比为5:4 B.原子总数之比为4:3
C.质量之比为1:1 D.分子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关0.1mol/LNa2S溶液的叙述正确的是( )
A.该溶液中存在两个平衡、七种粒子
B.该溶液中K+、NH ![]() 、NO
、NO ![]() 、Al3+可以大量共存
、Al3+可以大量共存
C.滴加少量稀硫酸,充分振荡无现象
D.通入足量SO2气体,发生反应的离子方程式:2S2﹣+SO2+2H2O═3S↓+4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞的原因是(用离子方程式表示):______________________________;玻璃试剂瓶不能盛放氢氟酸的原因是(用化学方程式表示):_____________________________________。
(2)实验室中的Na2SiO3溶液长期放置,瓶底会出现白色沉淀,则形成沉淀的离子方程式是___________________________。取瓶中的上层清液加入稀盐酸,观察到既有气泡产生又有沉淀生成,其离子方程式分别为_____________________________________。用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可做___________________的原料。
(3)某溶液中有NH4+、Mg2+、Fe2+、Fe3+、Al3+五种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是__________,有所增加的阳离子是___________。
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+ E. Fe3+
(4)质量相同的H216O和D216O所含质子数之比为 _______________, 中子数之比为____________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 摩尔是七个基本物理量之一 B. 阿伏加德罗常数是没有单位的
C. 1molH2O约含有6.02×1023 个水分子 D. 氮气的摩尔质量是28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为mol/(Lmin).
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=)
(4)比较实验4和实验1,可推测该反应是反应(选填“吸热”、“放热”).理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com