
 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.仅有② | C.②③④ | D.①②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
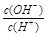 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.人类目前所直接利用的能量大部分是由化学反应产生的 |
| B.煤、石油、天然气是当今世界最重要的三种化石燃料 |
| C.我国目前最重要的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
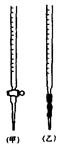
| A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤 |
| B.滴定前尖嘴部分有一气泡,滴定终点时消失 |
| C.定容时,俯视刻度线 |
| D.滴定前仰视读数,滴定后俯视读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 5.70 | 25.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com