
下列说法正确的是
A.离子键只存在于离子化合物中,共价键只存在于共价化合物中
B.热稳定性:NH3>PH3>AsH3;酸性:HClO4>H2SO4>H3PO3
C.BF3和CS2分子中所有原子的最外层都是8电子稳定结构
D.钠离子的半径大于镁离子的半径,氯离子的还原性强于硫离子的还原性
B
【解析】
试题分析:A、含有离子键的化合物是离子化合物。全部由共价键形成的化合物是共价化合物、这说明离子键只能存在于离子化合物,但共价键不一定只存在于共价化合物,在离子化合物(例如氢氧化钠等)和单质(例如氢气等)也可以存在共价键,B不正确;C、在共价化合物中元素化合价的绝对值与元素的最外层电子数之和满足即可满足8电子稳定结构。在BF3和CS2分子中B、F、C、S的化合价分别是+3价、-1价、+4价和-2价,所以F、C、S原子的最外层都是8电子稳定结构,但B原子并不满足,C不正确;D、核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以钠离子的半径大于镁离子的半径;非金属性越强,相应阴离子的还原性越弱。氯元素的非金属性强于硫元素,则氯离子的还原性弱于硫离子的还原性,D不正确,答案选B。
考点:考查元素周期律的应用与判断


科目:高中化学 来源: 题型:阅读理解

| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
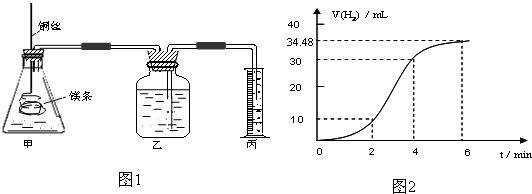
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com