
【题目】下列不能用于金属防腐处理的是( )
A. 涂油漆 B. 海轮在海洋上航行,为防止船体腐蚀,常在船体上镶上铜块
C. 在金属表面进行电镀 D. 改变金属内部结构
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中能大量共存的离子组是( )
A. Ca2+、Na+、NO3-、CO32- B. Na+、Cl-、NH4+、SO42-
C. K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+也同时被完全沉淀,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为( )
A. 1:1 B. 2:1 C. 3:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
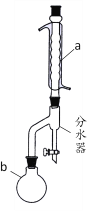
【题目】乙酸丁酯是优良的有机溶剂,因有愉快的果香气味,也用于香料工业。实验室制取乙酸丁酯的有关信息及装置示意图如下:
密度/(g·cm-3) | 沸点/℃ | 水溶性 | |
1-丁醇 | 0.81 | 117.7 | 可溶 |
乙 酸 | 1.05 | 117.9 | 互溶 |
乙酸丁酯 | 0.88 | 126.3 | 微溶 |
实验操作流程为:

(1)装置a的名称是_____________,其中冷却水的流动方向是____________。
(2)制取乙酸丁酯的化学方程式为___________________________________。加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是________________________________________。
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中。在分液漏斗中加入10mL水洗涤,除去下层,上层继续用10mL10%Na2CO3溶液洗涤至中性,分液后将上层液体再用10mL水洗涤,除去溶于酯中的少量无机盐。下列说法不正确的是____________(填序号)。
A.最初用10mL水洗涤的目的是除去酸及少量的正丁醇
B.用10mL10%Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是________________________。
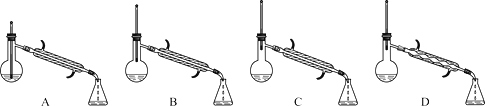
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)本实验的产率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素为利胆解痉药,适用于急性胆嚢炎治疗,其结构简式如图。下列有关叙述中正确的是( )

A. 分子中所有碳原子不可能共平面
B. 1mol亮菌甲素与澳水反应最多消耗3molBr2
C. 1mol亮菌甲素在一定条件下与Na0H溶液完全反应最多消耗2molNaOH
D. 1mol亮菌甲素在一定条件下可与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为CO、CO2、N2等,其中CO含量约占25%左右。
(1)研究表明,由CO可以直接合成多种化工产品,如生产甲醇。
已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ·mol-1。则CO(g)燃烧热为__________kJ·mol-1。
(2)人体中肌红蛋白(Mb)与血红蛋白(Hb)的主要功能为运输氧气与二氧化碳。肌红蛋白(Mb)可以与小分子X(如氧气或一氧化碳)结合,反应方程式为:Mb(aq)+X(g)![]() MbX(aq)
MbX(aq)
①通常用p表示分子X的压力,p0表示标准状态大气压,若X分子的平衡浓度为p/p0,写出上述反应的平衡常数表达式:K=__________.请用p/p0及K表示吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例__________。
②在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),下图最能代表结合率(f)与此两种气体压力(p)的关系的是____________
③人体中的血红蛋白(Hb)同样能吸附O2、CO2和H+,相关反应方程式及其化学平衡常数分别是:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq);K1
HbH+(aq);K1
Ⅱ.HbH+(aq)+O2(g)![]() HbHO2(aq)+H+;K2
HbHO2(aq)+H+;K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq)K3
HbO2(aq)K3
Ⅳ.HbO2(aq)+H+(aq)+CO2(g)![]() Hb(H+)CO2(aq)+O2(g);△H4
Hb(H+)CO2(aq)+O2(g);△H4
则K3=__________(用K1、K2表示),若低温下反应Ⅳ能自发进行,则该反应△H____0,△S__0(填“>”“<”或“=”)
(3)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=cmol/L,则c(CO32-)=_____mol/L(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醛生产PTT(聚酯)和化合物M 的某种合成路线如下:

回答下列问题:
(1)A中官能团名称为______.
(2)B生成C的反应类型为_______。
(3)C的结构简式为_______,D化学名称是_______。
(4)由D生成PTT的化学方程式为____________________。
(5)芳香化合物W是M的同分异构体,它的溶液滴入FeCl3溶液显紫色,W共有______种(不含立体结构),其中核磁共振氢谱为四组峰的结构简式为_________。
(6)参照上述合成路线,以乙醇和1,3-丁二烯为原料(无机试剂任选),设计制备合成 路线___________________。
路线___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com