
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 
【答案】
(1)酸雨;SO2+H2O?H2SO3;H2SO3?H++HSO3﹣
(2)H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39kJ?mol﹣1
(3)6.25×10﹣3mol/(L?min);225(mol/L);减小;通入足量的空气;反应很难进行
【解析】解:(1)SO2的大量排放会引起严重的环境问题是形成酸雨,二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2OH2SO3;H2SO3H++HSO3﹣ ,
所以答案是:酸雨;SO2+H2OH2SO3;H2SO3H++HSO3﹣;(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=﹣221.19 kJmol﹣1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42﹣(aq))△H=﹣585.20 kJmol﹣1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39 kJmol﹣1;
所以答案是:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39 kJmol﹣1 ;(3)①0﹣4min二氧化硫物质的量变化为0.10mol﹣0.050mol=0.050mol,反应速率v= ![]() =6.25×10﹣3mol/(Lmin),所以答案是:6.25×10﹣3mol/(Lmin);
=6.25×10﹣3mol/(Lmin),所以答案是:6.25×10﹣3mol/(Lmin);
②结合图表数据,5min时n(O2)= ![]() =0.03mol,剩余氧气物质的量=0.05mol﹣0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
=0.03mol,剩余氧气物质的量=0.05mol﹣0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
2SO2(g)+ | O2(g) | 2SO3(g) | ||
起始量(mol) | 0.1 | 0.05 | 0 | |
变化量(mol) | 0.06 | 0.03 | 0.06 | |
平衡量(mol) | 0.04 | 0.02 | 0.06 |
平衡常数= ![]() =
=  =225(mol/L)
=225(mol/L)
所以答案是:225(mol/L);
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),Qc= 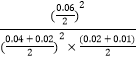 =
= ![]() =66.67<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小,所以答案是:减小;(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例,通入足量的空气,
=66.67<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小,所以答案是:减小;(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例,通入足量的空气,
所以答案是:通入足量的空气;②反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反应的平衡常数K= ![]() =
= ![]() =
= ![]() =
= ![]() =6.83×10﹣15<10﹣5 , 反应很难进行,
=6.83×10﹣15<10﹣5 , 反应很难进行,
所以答案是:反应很难进行;


科目:高中化学 来源: 题型:
【题目】将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气体(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)写出有关反应的方程式,是离子反应的写离子方程式:;;;
(2)2.24L气体的成分为:;
(3)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注.由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJmol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJmol﹣1
回答下列问题:
(1)反应Ⅱ的△H2= , 反应Ⅲ自发进行条件是(填“较低温”、“较高温”或“任何温度”).
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650KB.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650KD.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2 , 该反应10min时达到平衡:
a.用H2表示该反应的速率为;
b.该温度下,反应I的平衡常数K=;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得在不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是(选填编号).
A.改用高效催化剂 B.升高温度C.缩小容器体积 D.分离出甲醇 E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而(填“增大”、“减小”、“不变”或“无法判断”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学电源的叙述正确的是
A. 化学电源比火力发电对化学能的利用率高
B. 化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C. 化学电源均是安全、无污染的
D. 化学电源即为充电电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电的锂离子电池,以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池总反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热
B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉
D. 加入少量1 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中加入少量KMnO4酸性溶液,振荡后褪色,正确的解释为 ( )
A.苯的同系物分子中的碳原子数比苯分子中的碳原子数多
B.苯环受侧链影响易被氧化
C.侧链受苯环影响易被氧化
D.由于苯环和侧链的相互影响均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法与结论相符的一组是( )
序号 | 检 验 方 法 | 结 论 |
A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl﹣ |
B | 向一种未知溶液中滴加盐酸,有气泡产生 | 未知溶液中一定含有CO |
C | 将一种未知气体通入品红溶液,溶液褪色,加热后又恢复红色 | 未知气体是SO2 |
D | 向一种未知溶液中滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com