
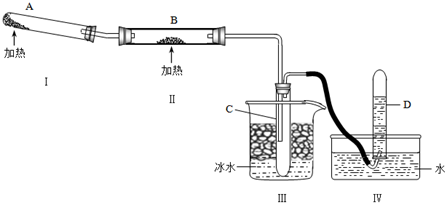
| ||
| ||


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
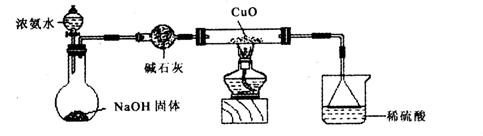
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组的同学在学习了NH3的性质时讨论:运用类比的思想,既然NH3具有还原性,能否像H2那样还原CuO呢?他们设计实验制取NH3并探究上述问题。请你参与该小组的活动并完成下列研究:
(1)制取NH3
①写出实验制取NH3的化学方程式 ;
②在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量NH3;
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和NH4Cl溶液的方法收集NH3。你认为他能否达到目的? (填“能”或“否”)。
(2)该小组中某同学设计了下图所示的实验装置(夹持未画出),探究NH3的还原性:

①该装置在设计上有一定缺陷,对该装置的改进措施是:
______________________________________________________________________
____________________________________________________________________。
②利用改进后的装置进行实验,充分反应后,观察到CuO全部变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出NH3与CuO反应的化学方程式 。
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ = Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:实验题
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。

请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高一上学期期末考试化学试卷(解析版) 题型:填空题
(11分)回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com