
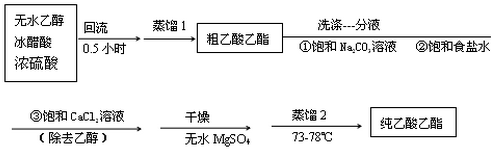
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
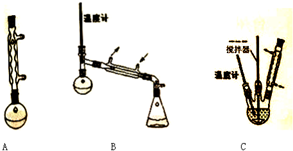
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第1次 | 0.00 | 1.98 |
| 第2次 | 1.98 | 4.00 |
| 第3次 | 4.00 | 5.80 |
| 第4次 | 5.80 | 7.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
| B | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| D | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和新戊烷 | |
| B. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| C. | 对氯甲苯和邻氯乙苯 | |
| D. | 甲基丙烯酸和甲酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 ,氯元素的原子结构示意图
,氯元素的原子结构示意图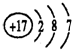 ;
; ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com