
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气泡产生 |
以下结论不正确的是
A.Ⅰ中无明显变化,说明两溶液不反应B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑D.Ⅲ中发生的反应是氧化还原反应
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】合成氨反应是重要的化工反应,请回答下列问题:
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1
H2O(g) △H=-299.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1
由上述反应,可求出N2(g)+3H2(g)![]() 2NH3(g)的△H=___。
2NH3(g)的△H=___。
(2)对于反应①,在恒温恒容(H2O为气态)的容器中,下列选项表明反应已达到平衡的是___。
A.混合气体的平均摩尔质量不变
B.混合气体的密度不变
C.气体的颜色不再变化
D.体系内压强不再变化
E.每消耗1molNH3的同时生成1molNO2
(3)已知:N2(g)+3H2(g)![]() 2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
(4)如图为673K温度下,某合成氨塔里各气体组分压强变化图。
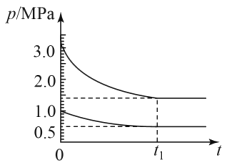
①t1平衡时,氨气的体积分数为___%(保留位小数)。
②在图中画出氨气组分压强变化图___。
③该温度下N2(g)+3H2(g)![]() 2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下10种化合物中,不能通过化合反应直接生成的有( )
①Fe3O4;②Fe(OH)3;③FeCl2;④CuS;⑤Cu2S;⑥Cu2(OH)2CO3;⑦Al(OH)3;⑧Na2CO3;⑨NaHCO3;⑩Na2O2
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西安兵马佣二号坑出土的宝剑因含有铬而锋利无比。目前,工业用硬铬尖晶石(属于含氧酸盐,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制备重铬酸钠(工业流程如图),同时电解重铬酸钠溶液便可得到铬。
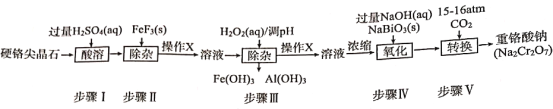
(1)硬铬尖晶石中,Cr的化合价为__。
(2)在步骤II中除去的离子是___,操作X的名称为___。
(3)写出步骤III中H2O2表现的性质是___,已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为___。(常温下:[Ksp[Cr(OH)3]=1.0×10-32,Ksp[Al(OH)3]=1.0×10-35,Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.约为10 D.约为4
(4)已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为___,步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是___。
(5)工业上用电解法制备铬,其装置示意图如图:
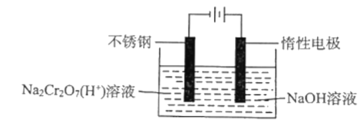
电解池工作时,阴极发生的电极反应式为___,该装置的电能主要转变为___能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3。试回答下列问题:

(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是_____________________。
(3)在双球干燥管内发生反应的化学方程式为______________________。
(4)双球干燥管内观察到的实验现象是____________________________。
上述实验现象说明____________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为3O2![]() 2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B.太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C.吸热反应就是反应物的总能量比生成物的总能量小的反应;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00mL浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NHH2O]=l.60×l0-4。下列说法正确的是( )
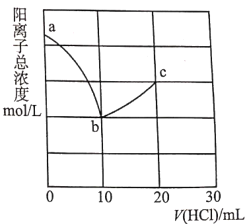
A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L
B.从a到c的过程中,水的电离程度最大的是b点
C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
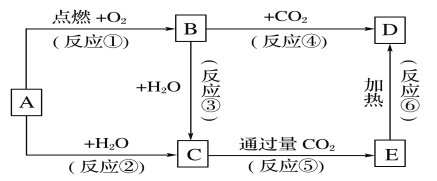
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
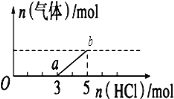
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com