
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
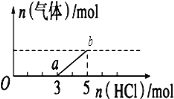
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
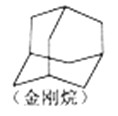
【题目】下列有关有机物的说法正确的是
A. HOCH2COOH在一定条件下可与O2、 NaHCO3溶液、乙醇、乙酸发生反应,且反应类型相同
B. C2H3COOC2H5存在C4H9COOH时可以加入饱和NaOH溶液后分液除去
C. 金刚烷(如图结构)含有属于芳香化合物的同分异构体
D. 与 NaHCO3溶液反应产生CO2的链状有机物C4H6O2,与HBr加成可生成5种同分异构体(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中NaHCO3的制备。下列说法错误的是
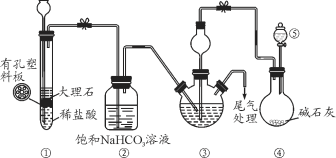
A. 装置①也可用于制取H2
B. ③、⑤中可分别盛放饱和食盐水和浓氨水
C. 应先向③中通入足量NH3,再通入足量CO2
D. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.最高正化合物:P>N>C
B.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2S
D.碱性:LiOH>NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1所示。
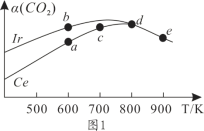
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(3)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_____________,电负性由大到小的顺序为__________________________________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是_________________________________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为________________________________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
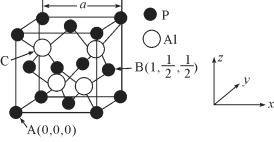
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验。已知无色气体B能形成酸雨。请回答:
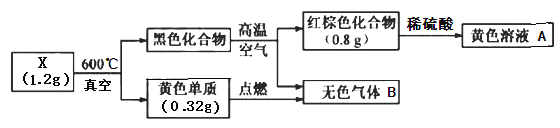
(1)X的化学式是________。
(2)设计实验方案检验黄色溶液中的金属阳离子___________________。
(3)将无色气体B通入黄色溶液A中,发现溶液变成浅绿色。请用离子方程式表示该反应_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案.

①按如图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象.
请回答下列问题.
(1)A中所发生反应的反应方程式为_____,能证明凯库勒观点错误的实验现象是______.
(2)装置B的作用是______.
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对氢气的相对密度为35.3,则实验结束时,进入烧瓶中的水的体积为______mL 空气的平均相对分子质量为29.
(4)已知乳酸的结构简式为![]() 试回答:
试回答:
①乳酸分子中含有______和______两种官能团写名称.
②乳酸跟氢氧化钠溶液反应的化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
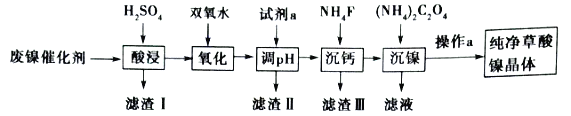
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_________________________________。
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:______________________。
(3)试剂a“调pH”时pH的调控范围为___________,试剂a为___________(填字母)
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:_________________________________。当Ca2+沉淀完全时,溶液中c(F-)>___________mol·L-1(写出计算式即可)。证明Ni2+已经沉淀完全的实验操作及现象是_________________________________。
(5)操作a的内容是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com