
【题目】3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g)![]() 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
A.B的平均消耗速率为0.3mol/(L![]() min)
min)
B.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡
C.平衡后,增大压强,平衡将向正反应方向移动
D.C的平衡浓度为2mol/L
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
A.c(N2O5)=1.44 mol/L B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L D.c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L丁烷中C—C键数目为0.4NA
B. 0.1mol葡萄糖分子中官能团数目为0.6NA
C. 28g N2和NO组成的混合物中分子数目可能为0.9NA
D. 1L pH =13的NaOH溶液中,Na+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属钠与水反应:Na+ H2O=Na++ H2
B. 氯化铵溶液显酸性的原因:NH4++H2O=NH3·H2O+H+
C. AICl3溶液中加入足量氨水:Al3++4NH3-H2O= AlO2-+4NH4+2H2O
D. 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S= 2Fe2++S+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1。
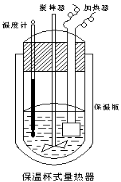
(1)试求CH3COOH的中和热△H = kJ/mol。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分析在(1)中测得的实验值偏差可能的原因 。(答两条原因)
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com