
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
A.c(N2O5)=1.44 mol/L B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L D.c(N2O)=3.48 mol/L
科目:高中化学 来源: 题型:
【题目】用如图I所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U型管右端液面上升。下列说法正确的是
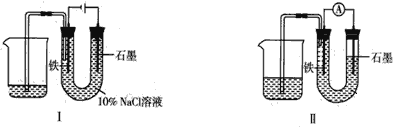
A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多
B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2
C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑
D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—FZ§X§X§K] | N—F |
键能/ kJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 过程N2(g)![]() 2N(g)放出能量
2N(g)放出能量
B. 过程N(g)+3F(g)![]() NF3(g)放出能量
NF3(g)放出能量
C. 反应N2(g)+3F2(g)![]() 2NF3(g)的ΔH>0
2NF3(g)的ΔH>0
D. NF3吸收能量后如果没有化学键的断裂与生成,仍能可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
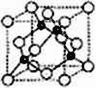
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50mol·L-1盐酸与50 mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。回答下列问题:
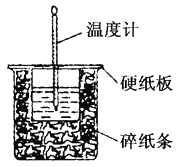
(1)小烧杯中发生反应的离子方程式为: ________________________________;
(2)该实验中反应发生过程中,温度计显示温度上升,说明该反应是__________反应(填”放热”或”吸热”)
(3)从能量的角度看,断开化学键要________________;形成化学键要_________________________;
(4)将实验中的药品换为铝片和稀盐酸,温度计显示温度上升。发生反应的化学方程式为______________________,反应物的总能量__________生成物的总能量(填”大于”或”小于”)
(5)目前,全球仍主要处于化石能源时期,下列有关能源说法正确的是__________;
A.煤、石油、天然气属于矿石能源,是取之不尽用之不竭的,可以大量使用
B.沼气的主要成分是甲醇,是一种清洁能源
C.太阳能、氢能、核能等以后将成为提供能源的重要形式
D.可利用风能发电来缓解枯水季节的电能不足
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A. 生成SO3 2 mol B. 放出197 kJ热量 C. SO2和SO3共2 mol D. 含氧原子共8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①泥浆中泥沙是溶质,水是溶剂
②医用酒精中,水是溶剂,酒精是溶质
③凡是分散质能通过半透膜的分散系即属于胶体
④通过丁达尔现象可以鉴别胶体和溶液
A.①②③④ B.②④ C.②③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A. NH4+、Cu2+、 Cl-、NO3- B. K+、Na+、CO32-、S2-
C. K+、Na+、 CH3COO-、SO42- D. Ba2+、Mg2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g)![]() 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
A.B的平均消耗速率为0.3mol/(L![]() min)
min)
B.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡
C.平衡后,增大压强,平衡将向正反应方向移动
D.C的平衡浓度为2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com