
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
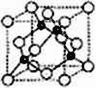
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
【答案】 1s22s22p63s23p63d54s1或[Ar]3d54s1 3p 硼原子的I3、I4对应的2个电子分別处于不同的能层或硼原子失去第3个电子后,达到稳定结构,不易再失去电子(或其他合理说法) B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2 NC13 分子间作用力或范德华力 化学键或共价键或极性键 CH4( NH3 BN ![]()
![]() ×1010
×1010
【解析】试题分析:因为A、B、C、D、E为原子序数依次增大的前四周期元素,基态A原子核外电子占锯3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,则基态B原子核外电子排布式为:1s22s22p2,故B为C元素;基态A原子核外电子排布式为:1s22s22p1,故A为B元素;C的双原子单质分子中σ键和π键数目之比为1:2,则C为N元素;基态E原子核外有6个未成对电子,则E处于第四周期,外围电子排布为:3d54s1,为Cr元素;D的最高正化合价和最低负化合价之和等于4,为S元素。综上分析,A为B元素、B为C元素、C为N元素、D为S元素、E为Cr元素。
(1)E为Cr元素,基态E原子的核外电子排布式为:1s22s22p63s23p63d54s1或[Ar]3d54s1;D为S元素,基态D原子核外电子占据的能量最高的能级符号为3p。
(2)基态B原子核外电子排布式为:1s22s22p1,所以硼原子失去第3个电子后,达到稳定结构,不易再失去电子(或者说,硼原子的I3、I4对应的2个电子分別处于不同的能层),因此硼原子相邻两个电子的电离能中,I3和I4之间差异最大;。故答案为:硼原子失去第3个电子后,达到稳定结构,不易再失去电子(或硼原子的I3、I4对应的2个电子分別处于不同的能层)。
(3)B、C、N的非金属性依次增强,所以B、C、N元素的最高价氧化物对应的水化物酸性依次增强;或者说,含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。故答案为:B、C、N的非金属性依次增强(或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2)。
(4)BCl3中硼原子价层电子对个数=3+![]() ×(33×1)=3,且不含孤电子对,采用sp2杂化,分子构型为平面三角形;CCl4分子中碳原子价层电子对个数=4+
×(33×1)=3,且不含孤电子对,采用sp2杂化,分子构型为平面三角形;CCl4分子中碳原子价层电子对个数=4+![]() ×(44×1)=4,且不含孤电子对,采用sp3杂化,分子构型为正四面体型;NCl3分子中价层电子对个数=3+
×(44×1)=4,且不含孤电子对,采用sp3杂化,分子构型为正四面体型;NCl3分子中价层电子对个数=3+![]() (53×1)=4,采用sp3杂化,该分子中含有一个孤电子对,所以其空间构型是三角锥型。故答案为:NCl3。
(53×1)=4,采用sp3杂化,该分子中含有一个孤电子对,所以其空间构型是三角锥型。故答案为:NCl3。
(5)由已知(SN)4高于130℃时分解,破坏的是化学键(或共价键或极性键);在低于该温度时发生的颜色变化中,破坏的作用力是分子间作用力(或范德华力)。C、N、S的简单气态氢化物中,CH4呈正四面体结构,四条键的极性刚好抵消,所以是非极性分子;NH3分子为三角锥形,氮原子为顶点,整个分子正负电荷中心不对称,所以是极性分子;硫最外层有6个电子,它和两个氢原子形成两对共用电子对后还有2对孤对电子,一共有4对电子在硫周围,这四对电子呈四面体型结构,其中两个方向被氢占据,还有2个方向被孤电子对占据,所以分子呈V型,正负电荷中心不能重合,为极性分子。NH3中H的电子云严重偏向N,使得N的孤对电子十分突出,配位能力很强,常与Cu2+、Zn2+、Ag+等形成配离子。综上分析,答案为:分子间作用力或范德华力;化学键或共价键或极性键;CH4;NH3。
(6)如图,B(白色)占据立方体的8个顶点和6个面心,所以有8/8+6/2=4个;N(黑色)占据八分之一个晶胞的中心,共4个,故该晶体的化学式为:BN;设晶胞边长为a、键长为d,则d=![]() a,根据已知条件可得:a=
a,根据已知条件可得:a= pm =
pm =  pm,所以d=
pm,所以d=![]() ×
× pm。
pm。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】己知可逆反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。回答下列问题

(1)操作①过程中,C1棒为__________极,C2棒上发生的反应为______________________
(2)操作②过程中盐桥中的_________离子移向(I)烧杯,C1棒上发生的反应为_____________
(3)若将微安表换成电解冶炼铝装置,写出电解总反应方程式__________________________________
(4)若将微安表换成电解精炼铜装置,在操作②过程中与C2棒连接的为_________电极,电解一段时间后,溶液中CuSO4溶液的浓度_____________(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化:

(1)A的结构简式为: 。
(2)E是(写结构简式) ; D中含官能团名称 ;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应。
③: 反应类型: 反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+ 与 Al3+ 的化学性质相似,在Cr2(SO4)3 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42 和 Cr2O72 在溶液中可相互转化。室温下,初始浓度为1. 0 mol·L1的Na2CrO4 溶液中c(Cr2O72) 随c(H+) 的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性减小,CrO42 的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的逆反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH____0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的 Cr2O72 还原成 Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
A.c(N2O5)=1.44 mol/L B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L D.c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关48Ti和50Ti的说法正确的是( )
A.48Ti和50Ti的质子数相同,互称同位素
B.48Ti和50Ti的质量数不同,属于两种元素
C.48Ti和50Ti的质子数相同,是同一种核素
D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com