
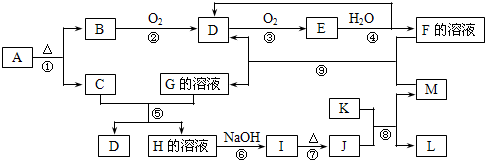
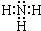 ,故答案为:
,故答案为: ;
;
| ||
| △ |
| ||
| ||


科目:高中化学 来源: 题型:
| A、1molH2O含有6.02×1023个分子 |
| B、0.012Kg12C中含有6.02×1023个碳原子 |
| C、1molH2O中含有2 mol氢和1mol氧 |
| D、1molH2O中含有3 mol原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
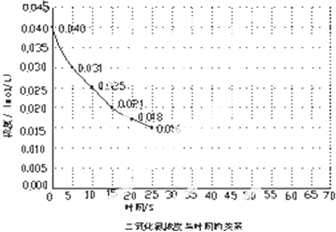
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、通过裂解可以从石油中获得更多的乙烯 |
| B、把煤干馏不能直接得到苯 |
| C、制聚苯乙烯的反应①为加成反应,③为缩聚反应 |
| D、反应①②③的原子利用率都达到了100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com