
| m |
| M |
| n |
| V |
| 3.2g |
| 64g/mol |
| 0.05mol×2 |
| 3 |
| 1 |
| 30 |
| 0.05mol×3 |
| 3 |
| 1 |
| 30 |
| 0.05mol |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、溶液中含有1 mol NaCl |
| B、1 L溶液里含有NaCl 58.5克 |
| C、58.5 g NaCl溶于941.5 g水中 |
| D、1 mol NaCl溶于1 L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 气态有机物 A在标准状况下密度为1.25g/L,A在一定条件下可以合成聚合物B,B可作食品包装袋.
气态有机物 A在标准状况下密度为1.25g/L,A在一定条件下可以合成聚合物B,B可作食品包装袋.查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO2(g)+O2(g)=2SO3(G)反应过程的能量变化如图所示.已知l mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下问题;
2SO2(g)+O2(g)=2SO3(G)反应过程的能量变化如图所示.已知l mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下问题;| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
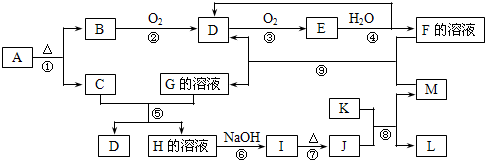
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
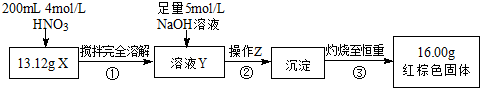
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铝热反应原理
(1)铝热反应原理| 实验步骤 | 现象 | 结论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设Ⅰ成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mo1/L KSCN溶液 | 深液不变色 |
| 编号 | 实验步骤 |
| 1 | ①滴加饱和FeC13溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| 2 | ①滴加4滴1mol?L-1 KSCN溶液 |
| ②滴加几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体颜色保持不变 |
| B、体系压强保持不变 |
| C、SO3和NO的体积比保持不变 |
| D、每消耗1 mol SO3的同时生成1 mol NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com