
| A. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-═CaCO3↓+SO42- | |
| B. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| C. | 铂电极电解MgCl2饱和溶液:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| D. | H+(aq)+OH(aq)═H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
分析 A、工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,从沉淀的转化的角度考虑,应是转化为溶解度更小的物质;
B、燃烧1mol乙炔(C2H2)气体时生成液态水和CO2放出的热量称为燃烧热;
C、铂电极电解MgCl2饱和溶液生成氢氧化镁、氢气和氯气;
D、浓硫酸溶于水的过程会放出热量,根据中和反应的反应热知识来判断.
解答 解:A、CaSO4是一种强酸强碱盐,碳酸钙为弱酸强碱盐,工业上用Na2CO3溶液浸泡锅炉水垢使其中CaSO4能转化为CaCO3,可说明CaSO4溶解度大于CaCO3,使水垢疏松,易于处理,反应为:CaSO4+CO32-═CaCO3↓+SO42-,故A正确;
B、燃烧1mol乙炔(C2H2)气体时生成液态水和CO2放出的热量称为燃烧热,该反应的反应热不是生成液态水,故B错误;
C、铂电极电解MgCl2饱和溶液:2H2O+MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2+Cl2↑+H2↑,故C错误;
D、含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出的热量大于57.3 kJ,故D错误.
故选A.
点评 本题涉及沉淀的转化、热烧热的概念、电解方程式的书写以及中和反应的热效应等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实 验 | 实验分离水和酒精 | 用铵盐和碱制取氨气 | 用排空气法收集二氧化氮 | 用自来水制取蒸馏水 |
| 装置或仪器 | 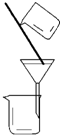 |  | 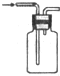 | 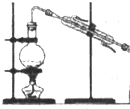 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中有红色金属析出 | B. | 有气体产物生成 | ||
| C. | 钠熔成小球并在液面上到处游动 | D. | 生成蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 光导纤维是以二氧化硅为主要原料制成的 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 绿色食品是指不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 在硅酸钠溶液中滴加稀硫酸:SiO32-+2 H+═H2SiO3↓ | |
| D. | 烧碱溶液中加入NaHCO3溶液:OH-+HCO3-═H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 v(C)正=3v(D)逆 | |
| B. | 若升高温度最终能生成更多的C和D | |
| C. | 单位时间里有4n mol A消耗,同时有5n mol B生成 | |
| D. | 容器里A、B、C、D的浓度比一定是4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度为0.1 mol/L 的FeI2溶液中通入Cl2,Fe2+先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向等浓度的FeCl3溶液加入质量相等且颗粒大小相同的铁和铜,铜先反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com