
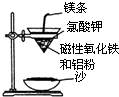
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
分析 (1)①考虑生成的熔融的铁的还原性,可以被空气中的氧气氧化导致生成三价的铁;
②根据铝与铁的性质的差异性来选择试剂,并写出反应的化学方程式;
(2)①确保A组实验在39℃下进行,可以采用水浴加热的方法;
②探究化学反应速率的影响因素时,需要保证变量的唯一性;
③根据“淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色”进行判断;
④根据ABC探究的是温度对反应速率的影响可知,D应该为探究酸度对反应速率的影响,据此完成本题;
⑤酸溶液浓度越大,反应速率越快,需要的时间越少,据此设计实验并写出结论.
解答 解:(1)①铝热反应生成的熔融的铁具有很强的还原性,可以被空气中的氧气氧化导致生成三价的铁,
故答案为:熔融的铁被空气中氧气氧化;
②要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)①为确保A组实验在39℃下进行,应采用的控温操作方法为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度,
故答案为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度;
②为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变,所以在A-C三组实验时,都加入了5mL水,
故答案为:为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分);
③淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色,所以B组实验中“没出现蓝色”,可能是温度(TB)高于75℃,淀粉与碘不显色,
故答案为:温度(TB)高于75℃,淀粉与碘不显色;
④A-C三组实验探究了温度对反应速率的影响,实验的目的是探究温度和酸度对反应速率的影响,则D的目的是探究酸度对反应速率的影响,所以温度可以为39或5℃,硫酸体积可以为15mL,水、碘化钾溶液的体积为5mL,淀粉溶液为1mL,
故答案为:
| D | 39或5 | 15 | 5 | 5 | 1 |
点评 本题考查铝热反应、探究影响化学反应速率因素等知识点,为高频考点,明确影响化学反应速率原理、铝热反应原理是解本题关键,注意:探究影响化学反应速率因素时必须只有一个因素不同,其它因素必须完全相同,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 开始析出晶体后用玻璃棒搅拌 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
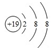
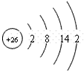
| A. | 过氧化钠的电子式: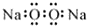 | B. | Cl-离子的结构示意图: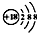 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | HClO的结构式为H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
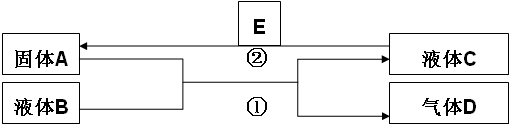
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com