
【题目】一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
C(g)+D(g),当下列物理量不发生变化时,能作为该反应已达到化学平衡状态的标志是( )
①混合气体的密度②容器内气体的压强③混合气体的总物质的量④B物质的量浓度
A. ①④ B. ②③ C. ②③④ D. 只有④
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.Na2O,CaO,Al2O3均为碱性氧化物
B.液溴不导电,所以液溴是非电解质
C.12C与13C的核外电子排布方式相同,化学性质相同
D.只含共价键的物质一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是( )
A.Cu、Fe3+
B.Fe2+、Fe3+
C.Cu、Cu2+
D.Cu、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是
A. 将铁屑、溴水、苯混合制溴苯 B. 苯和硝基苯采用分液的方法分离
C. 苯可以使酸性KMnO4溶液褪色 D. 用水鉴别:苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用子炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________。
(2)将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②反应过程中测得甲醇的体积分数α(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH______0(填“>”、“<”或“=”)。
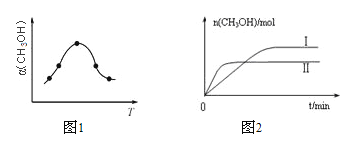
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
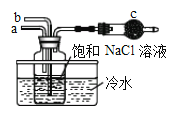
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_____处通入NH3气体,然后再在_______处通入CO2气体。
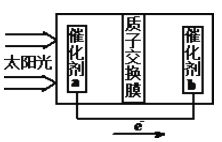
②人工光合作用能够借助太阳能用CO2和水制备化学原料,右图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关微量元素的下列说法中正确的是
A. 摄入的铁越多越有利于健康
B. 微量元素又称为矿物质元素
C. 婴幼儿或成人缺碘可引起甲状腺肿
D. 含量低于0.01%的微量元素,对于维持生命活动、促进健康和发育极其重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
请回答下列问题:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是___________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是____________。
(3)步骤④中洗涤粗硝基苯使用的仪器是_____________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是__________________。
(5)写出制硝基苯的方程式________。纯硝基苯是无色、密度比水_____(填“小”或“大”),具有________气味的油状液体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1mol·L-1Na2CO3溶液加适量水稀释,下列各项随着加水量的增大而减小的是
A. n(OH-) B. 溶液的pH
C. c(H+)·c(OH-) D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com