

| A. | 负极反应为:Cu-2e-═Cu2+ | |
| B. | 若该原电池工作前两电极质量相等,则工作后,当铜的质量减少6.4g时,两电极质量相差21.6g(假设电解质溶液都是足量的) | |
| C. | 当铜的质量减小12.8 g时,外电路中通过0.4mol电子 | |
| D. | 原电池的总反应式为:Cu+2AgNO3═2Ag+Cu(NO3)2 |
分析 该电池中,较活泼的金属铜做负极,负极上铜失去电子发生氧化反应;较不活泼的银做正极,正极上得电子发生还原反应;外电路中,电子从负极沿导线流向正极;
该原电池中盐桥的作用是平衡两个半电池中的阴、阳离子使该装置构成闭合电路,据此分析.
解答 解:A、铜是负极,电极反应式为:Cu-2e-═Cu2+,故A正确;
B、当铜的质量减少6.4g时,则右边析出银的物质的质量为:$\frac{6.4}{64}×2×108$=21.6g,所以两极质量差为:21.6g+6.4g=28g,故B错误;
C、当铜的质量减小12.8 g时,物质的量为:$\frac{12.8g}{64g/mol}$=0.2mol,所以外电路中通过0.4mol电子,故C正确;
D、该原电池的总的反应式为:Cu+2AgNO3═2Ag+Cu(NO3)2,故D正确;
故选B.
点评 本题考查了原电池的原理,明确盐桥的作用,并会对电极进行判断,书写电极反应式是解题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
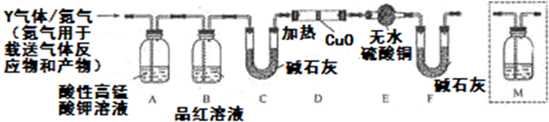
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 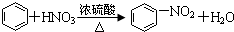 | |
| B. | 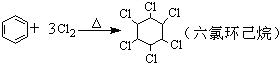 | |
| C. | 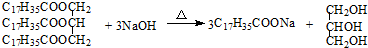 | |
| D. | CH3CH=CH2+Cl2$→_{△}^{500℃}$ClCH2CH═CH2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水,烧碱溶液,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 澄清石灰水,浓H2SO4 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
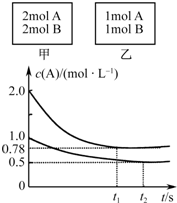 向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )| A. | 甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) | |
| B. | x不可能等于2 | |
| C. | 将乙容器升温可使甲、乙容器内各物质的体积分数相同 | |
| D. | 若向甲容器中再充入2mol A、2mol B,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com