
分析 (1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(2)参加反应的NO3-的物质的量是酸性的硝酸根与氧化性的硝酸物质的量之和;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=$\frac{n}{V}$计算;
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,用30%的双氧水氧化,双氧水得到的电子等于NO、NO2失去的电子,根据电子得失守恒计算;
解答 解:(1)32.64g铜的物质的量为n=$\frac{m}{M}$=$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=1.02}\end{array}\right.$,
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
故答案为:5.824;5.376;
(2)参加反应的NO3-的物质的量是酸性的硝酸根与氧化性的硝酸物质的量之和,即0.51mol×2+0.5mol=1.52mol,故答案为:1.52mol;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=V×10-3L×amol/L=aV×10-3 mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=aV×10-3 mol+0.5mol=(aV×10-3+0.5)mol,故硝酸的物质的量浓度=$\frac{(aV×1{0}^{-3}+0.5)mol}{0.14L}$=$\frac{0.1aV+50}{14}$mol/L,
故答案为:$\frac{0.1aV+50}{14}$;
(4)用30%的双氧水使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,双氧水得到的电子等于NO、NO2失去的电子,设需要30%的双氧水mg,根据电子得失守恒,有:0.26×3+0.24×1=0.51×2=30%×$\frac{m}{34}$×2,解得:m=57.8g,
故答案为:57.8g.
点评 本题以硝酸为载体考查了氧化还原反应的计算,根据氧化还原反应中得失电子进行解答即可,注意守恒思想的运用,注意(3)中不能根据铜计算消耗硝酸的物质的量,铜和硝酸反应时,硝酸可能有剩余,为易错点,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、SiO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、H2SO4、Na2O、CaCl2 | B. | MnO2、HNO3、KOH、K2CO3 | ||
| C. | SO2、NaHSO4、Ca(OH)2、KCl | D. | H2O、HCl、纯碱(Na2CO3)、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
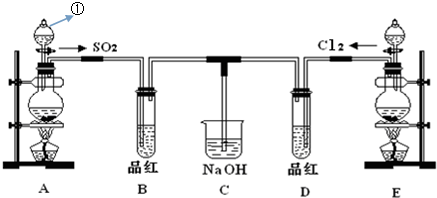
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
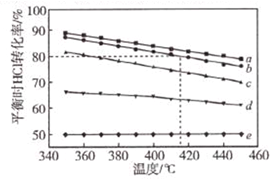 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 负极反应为:Cu-2e-═Cu2+ | |
| B. | 若该原电池工作前两电极质量相等,则工作后,当铜的质量减少6.4g时,两电极质量相差21.6g(假设电解质溶液都是足量的) | |
| C. | 当铜的质量减小12.8 g时,外电路中通过0.4mol电子 | |
| D. | 原电池的总反应式为:Cu+2AgNO3═2Ag+Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com