
| A、难溶电解质的溶度积越小,溶解度越大 |
| B、一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
| C、升高温度,物质的溶解度都会增大 |
| D、可以通过沉淀反应使杂质离子完全沉淀 |


科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、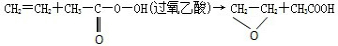 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入的碱过量 |
| B、生成的盐不水解 |
| C、酸与碱等物质的量混合 |
| D、反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将标准状况下1.12L氯气通入10mL 1mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3?H2O+H2O |
| D、向NaHSO3溶液中滴入适量NaClO溶液:HSO3-+ClO-=SO42-+H++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+ |
| B、I- |
| C、Na+ |
| D、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2个甲基,可能生成4种一氯代物 |
| B、3个甲基,可能生成5种一氯代物 |
| C、3个甲基,可能生成3种一氯代物 |
| D、4个甲基,可能生成4种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com