

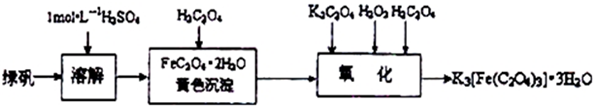
分析 以铁屑为原料制备三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O的流程:铁和硫酸反应:Fe+H2SO4=FeSO4+H2↑,硫酸亚铁和草酸反应:FeSO4+H2C2O4+2H2O=FeC2O4•2H2O+H2SO4,加入草酸钾、双氧水生成K3[Fe(C2O4)3]•3H2O.
(1)为完全溶解铁需要确保稀硫酸过量,同时溶液中的Fe2+易水解,需要滴加过量稀硫酸抑制其水解;
(2)过氧化氢是不稳定的氧化物,温度过高易分解,同时还应考虑温度对反应速率的影响;
(3)步骤④加热煮沸可除去滤液中过量的过氧化氢,防止产品氧化,提高产品纯度;
(4)步骤⑤操作的目的是将浓缩后的溶液冷却结晶并过滤、洗涤、干燥得到目标产物;
(5)根据三草酸含铁酸钾晶体溶于水.难溶于乙醇的性质选择洗涤剂;
(6)①影响反应速率的外界因素包括温度、催化剂及浓度等,可结合滴定过程中环境因素考虑;
②草酸根离子被高锰酸钾氧化成二氧化碳,本身被还原成锰离子,根据方程式是分析,0.1mol•L-1的酸性高锰酸钾溶液进行滴定,达到滴定终点时消耗酸性高锰酸钾溶液24mL,则草酸根离子物质的量浓度为$\frac{5×0.1×0.024}{2×0.02}$=0.3mol/L,所以10.0克中三草酸合铁酸钾晶体的物质的量为0.3×$\frac{0.1}{3}$=0.01摩尔,其质量分数为0.01×$\frac{491}{5.0}$×100%=49.1%
③依据滴定误差分析的方法判断,误差可以归结为标准液的体积消耗变化分析误差,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,
A.酸式滴定管水洗后,要用标准液润洗;
B.滴定前滴定管尖嘴处无气泡,滴定后有气泡,读取标准溶液体积减小;
C.摇动锥形瓶过程中有液体溅出,说明消耗标准液减小;
D.接近终点时,用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴,导致消耗标准液增大.
解答 解:以铁屑为原料制备三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O的流程:铁和硫酸反应:Fe+H2SO4=FeSO4+H2↑,硫酸亚铁和草酸反应:FeSO4+H2C2O4+2H2O=FeC2O4•2H2O+H2SO4,加入草酸钾、双氧水生成K3[Fe(C2O4)3]•3H2O.
(1)添加过量硫酸,可使铁粉完全溶解,同时还能抑制溶液中的Fe2+易水解,故答案为:使铁屑充分利用,同时制得的FeSO4溶液呈酸性,防止Fe2+的水解;
(2)温度保持40℃左右,可防止温度过高过氧化氢分解,温度太低影响反应速率,故答案为:温度太高双氧水容易分解,温度太低反应速率太慢等;
(3)为防止过量过氧化氢对产品纯度的影响,需要借助煮沸除去,故答案为:除去过量的双氧水;
(4)通过将浓缩后的溶液冷却结晶、过滤、洗涤、干燥后得到产品,故答案为:冷却结晶;
(5)为减小三草酸含铁酸钾晶体的溶解,提高产品的量,步骤⑤可选择乙醇作洗涤剂,故答案为:C;
(6)①滴定过程中发现,随着滴入KMnO4标准溶液,反应速率逐渐加快,可能原因是反应中生成的Mn2+起催化作用,加快反应速率,故答案为:生成的Mn2+起催化作用;
②5K3[Fe(C2O4)3]•3H2O~15C2O42-~6MnO4-
5×491g 6mol
x 24.00mL×10-3×0.1mol•L-l
x=0.982
K3[Fe(C2O4)3]•3H2O的质量分数$\frac{0.982g}{1g}$×100%=98.2%,
故答案为:98.2%.
③由c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$可知,
A.酸式滴定管要用标准液润洗,滴定管用蒸馏水洗涤后,立即装入标准液,标准液浓度减小,消耗标准液体积增大,测定结果偏高,故A符合;
B.滴定前滴定管尖嘴处无气泡,滴定后有气泡,读取标准溶液体积减小,测定结果偏低,故B不符合;
C.摇动锥形瓶过程中有液体溅出,说明消耗标准液减小,测定结果偏低,故B不符合;
D.接近终点时,用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴,导致消耗标准液增大,测定结果偏高,故D符合;
故答案为:AD.
点评 本题考查了物质性质的实验探究,实验方案的设计与分析计算,主要是滴定实验的过程分析和误差分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:推断题

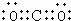 ,Y的名称是浓硫酸
,Y的名称是浓硫酸查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn为电池的负极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
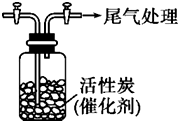 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义. CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
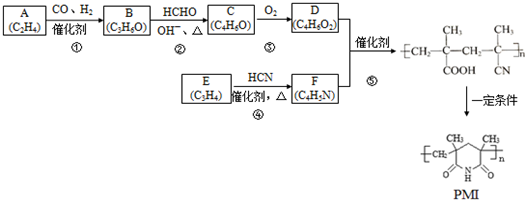
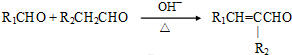 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)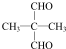 .
.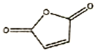 和
和 反应可制备
反应可制备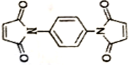 .然后以
.然后以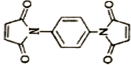 为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$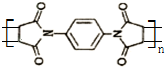 (X中无碳碳双键)
(X中无碳碳双键)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com