
A.2H2(g)+O2(g)  2H2O(l)△H= -142.9kJ·mol—1 2H2O(l)△H= -142.9kJ·mol—1 |
B.H2(g)+1/2 O2(g)  H2O(l)△H= -285.8kJ·mol—1 H2O(l)△H= -285.8kJ·mol—1 |
C.2H2+O2 2H2O(l)△H= -571.6kJ·mol—1 2H2O(l)△H= -571.6kJ·mol—1 |
D.H2(g)+1/2 O2(g)  H2O(g) △H= -285.8kJ·mol—1 H2O(g) △H= -285.8kJ·mol—1 |
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2 ______________ ④2HgO
______________ ④2HgO 2Hg+O2↑
2Hg+O2↑
 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。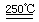 HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(1分)
HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(1分) 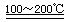 2HI+H2SO4(1分) ②:2H2SO4
2HI+H2SO4(1分) ②:2H2SO4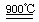 2SO2↑+O2↑+2H2O (1分) SO2和I2可循环使用,无污染。(1分)
2SO2↑+O2↑+2H2O (1分) SO2和I2可循环使用,无污染。(1分) 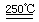 HgO+CaBr2; 循环过程需要很高的能量,且使用重金属汞,会产生污染。生产过程中贯彻落实“绿色化学”的思想。
HgO+CaBr2; 循环过程需要很高的能量,且使用重金属汞,会产生污染。生产过程中贯彻落实“绿色化学”的思想。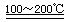 2HI+H2SO4 ;:2H2SO4
2HI+H2SO4 ;:2H2SO4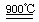 2SO2↑+O2↑+2H2O ; SO2和I2可循环使用,无污染。
2SO2↑+O2↑+2H2O ; SO2和I2可循环使用,无污染。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.硝酸钾溶于水; | B.氨气和氯化氢反应生成氯化铵晶体; |
| C.水蒸气凝结为液态的水; | D.(NH4)2CO3分解生成二氧化碳、氨气和水。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 TiCl4
TiCl4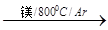 Ti
Ti | A.DH3 +2DH1-2DH2 | B.DH3 +DH1-DH2 |
| C.DH3 +2DH1-DH2 | D.DH3 +DH1-2DH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
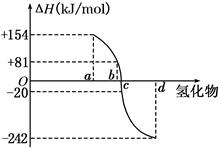
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.键能越大,表示该分子越容易受热分解 |
| B.共价键都具有方向性 |
| C.在分子中,两个成键的原子间的距离即为键长 |
| D.H—Cl的键能为431.8 k J /mol,H—Br的键能为366 k J /mol,这可以说明HCl分子比HBr分子稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都是直线形结构 | B.中心原子都采取sp杂化 |
| C.S原子和C原子上都没有孤电子对 | D.SO2为V形结构,CO2为直线形结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 列叙述中正确的是( )
列叙述中正确的是( )| A.MgSO4晶体中只存在离子键 |
| B.CH4、CO2都是由极性键构成的 |
| C.碱金属位于周期表中ⅠA主族,其密度均小于水 |
| D.次氯酸的结构式:H—Cl—O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com