
分析 铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g,
根据电子守恒列方程:2x+1×y=0.05mol×4,
解得:x=0.05mol,y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
答:合金中铜的质量为3.2g.
点评 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.


科目:高中化学 来源: 题型:填空题

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
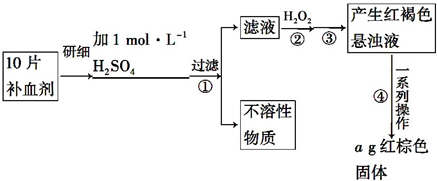
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2S和PH3含有相同的原子数 | |
| B. | NH3的摩尔质量为17 | |
| C. | 9.03×1023个CO2分子的质量为66g | |
| D. | 同温同压下,相同体积的物质,其物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中一定有铜,可能有铁 | |
| B. | 烧杯中铁铜都有 | |
| C. | 溶液中一定有Fe2+,可能有Cu2+、Fe3+ | |
| D. | 烧杯中有铁无铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和NO2都是共价化合物 | B. | 在SiO2晶体中,不存在单个小分子 | ||
| C. | CCl4是以极性键结合的非极性分子 | D. | 二氯甲烷不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
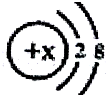 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com